BMS的CAR-T细胞疗法治疗多发性骨髓瘤,已获得FDA批准
2021-03-27 Allan MedSci原创
Bristol Myers Squibb(BMS)和蓝鸟生物公司(Bluebird Bio)周五宣布,FDA已批准其靶向BCMA的CAR-T细胞疗法Abecma。
Bristol Myers Squibb(BMS)和蓝鸟生物公司(Bluebird Bio)周五宣布,FDA已批准其靶向BCMA的CAR-T细胞疗法Abecma(idecabtagene vicleucel)的申请,以治疗复发或难治性多发性骨髓瘤患者。Bristol Myers Squibb首席医学官Samit Hirawat表示:“CAR-T细胞疗法已显示出具有治疗血液系统恶性肿瘤的潜力”。
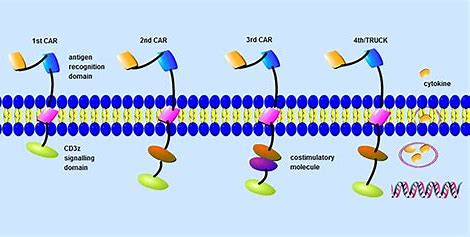
该疗法被批准为一次性输注,推荐剂量范围为300至460 * 106 CAR阳性T细胞,适用于至少接受过4种先前疗法的患者,包括免疫调节剂、蛋白酶体抑制剂和抗CD38单克隆抗体。
两家公司表示,这项批准得到了关键的II期KarMMa试验数据的支持,该试验评估了Abecma(idecabtagene vicleucel)治疗复发或难治性多发性骨髓瘤(127例患者)的有效性和安全性。最近发表在NEJM上的结果显示,在可评估疗效的100例患者中,Abecma(idecabtagene vicleucel)组的总缓解率(ORR)为72%。
Bristol Myers Squibb和蓝鸟生物公司(Birdbird bio)表示,患者迅速看到了治疗效果,响应时间为15至88天,中位数为30天。所有反应者的反应持续中位时间为11个月,而达到严格完全反应(sCR)的28%患者的反应时间延长至19个月。两家公司指出,在后一个队列中,估计有65%的患者至少缓解了一年。
原始出处:
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言










#CAR-#
39
#多发性#
31
#FDA批准#
46
期待,不过感觉步伐慢了一点
89
#Car-T细胞疗法#
48
#BMS#
57
#T细胞疗法#
51
CAR-T细胞疗法治疗多发性骨髓瘤
99
我学到了很多东西谢谢老师
107