【Cancer】Ph+ ALL异基因移植后伊马替尼对比达沙替尼维持治疗的长期结局
2024-02-24 聊聊血液 聊聊血液 发表于上海
国内学者联合开展一项多中心回顾性分析,纳入allo-HSCT后接受TKI维持治疗的Ph+ ALL患者,以比较伊马替尼(n=91)和达沙替尼(n=50)预防治疗对HSCT后长期结局的影响。
Ph+ ALL移植后TKI预防治疗
费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)传统化疗时代预后极差,5年总生存率(OS)不足20%,彼时异基因造血干细胞移植(allo-HSCT)是唯一治愈手段。在引入酪氨酸激酶抑制剂(TKI)治疗Ph+ ALL后,患者的生存期得到显著改善,但长期随访数据表明,在首次完全缓解(CR1)期未接受移植的患者仍然比接受移植的患者复发风险更高。以TKI为基础的治疗序贯allo-HSCT巩固治疗是适合移植的Ph+ ALL成人患者的标准策略。
HSCT后疾病复发是导致治疗失败的主要原因,HSCT后维持治疗已成为一种治疗策略,可降低移植后的复发率和延长生存期。但关于TKI的选择(一代还是二代)报道较少。因此,国内学者联合开展一项多中心回顾性分析,纳入allo-HSCT后接受TKI维持治疗的Ph+ ALL患者,以比较伊马替尼(n=91)和达沙替尼(n=50)预防治疗对HSCT后长期结局的影响。研究结果近日发表于《Cancer》,通讯作者为浙江大学附属第一医院罗依教授。

研究方法
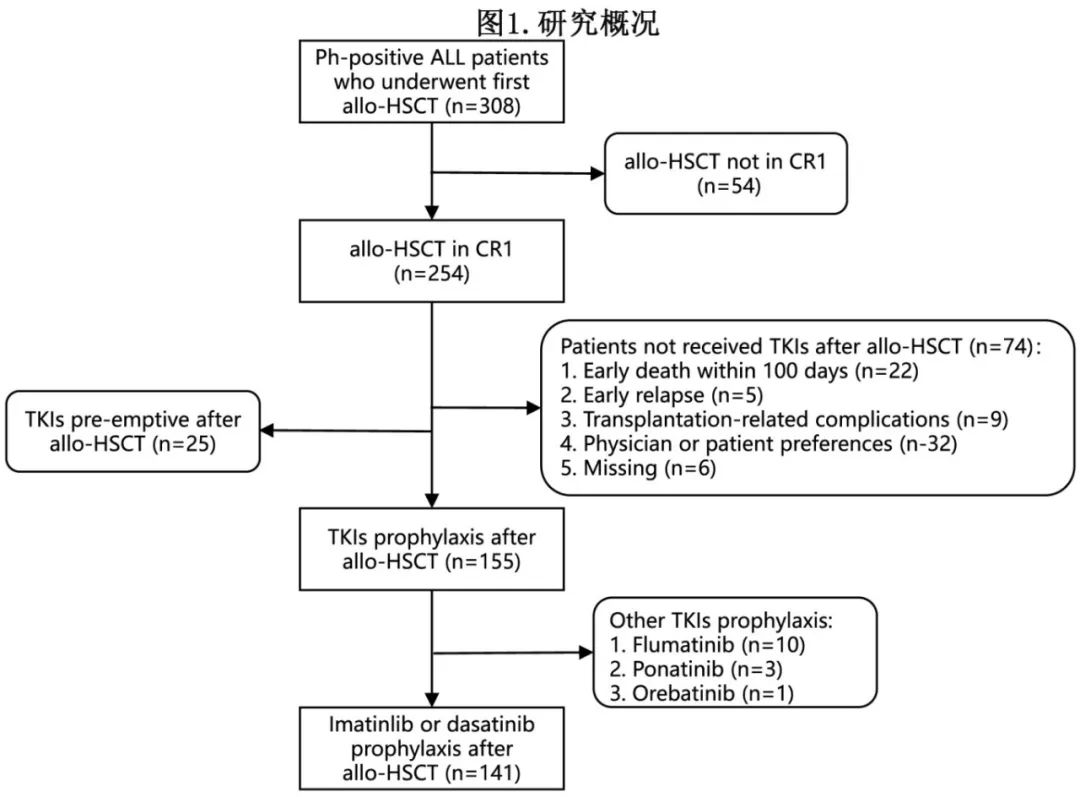
该多中心回顾性研究纳入2010.9-2021.10期间,在中国6家中心接受CR1期首次allo-HSCT 且在移植后接受伊马替尼或达沙替尼预防治疗的所有新诊断Ph+ ALL患者共141例,包括伊马替尼91例和达沙替尼50例(图1)。注:TKI 预防(TKI prophylaxis)定义为在检测到 MRD 和临床复发前给予TKI,而TKI抢先治疗(TKI pre‐emptive)定义为在检测到 MRD 后但在临床复发前给予TKI。
所有患者移植前均接受化疗,由医生根据治疗中心的实践选择方案。预处理方案和移植物抗宿主病(GVHD)预防的方案先前有报道。大多数患者接受白消安+环磷酰胺(BUCY)或改良BUCY清髓性预处理方案,而少数患者接受减低强度方案(白消安和氟达拉滨)。GVHD的预防方案包括环孢素A、甲氨蝶呤和小剂量吗替麦考酚酯。ATG‐T(无关供者[URD]‐HSCT:总剂量为4.5-6 mg/kg;半相合亲缘供者[HRD] – HSCT:总剂量6.5-10 mg/kg)或ATG - F (HRD -HSCT:总剂量10-20 mg/kg)也用于接受无关或半相合亲缘供者的病例。
移植后造血功能恢复(通常在移植后100天)后,患者接受伊马替尼(Ima队列)或达沙替尼(Das队列)预防复发。伊马替尼推荐剂量为400mg/天,达沙替尼推荐剂量为100mg/天,但可根据不良反应调整剂量。计划的治疗持续时间为1~2年,或持续至疾病进展或对毒性不耐受。
研究结果
患者和移植特征
共141例(55.5%)符合条件的患者纳入研究(图1),包括伊马替尼组91例和达沙替尼组50例。表1列出了基线人口统计学和疾病特征。患者中位年龄37岁,女性略多见。大多数基线特征在两队列中平均分布,但Ima队列中更多的患者在HSCT前接受伊马替尼治疗(Ima队列中83.5% vs Das队列中16%),而Das队列中更多的患者在HSCT前接受达沙替尼治疗(Ima队列中9.9% vs Das队列中64%)(p<0.001)。

大多数患者接受亲缘供者清髓性移植。除Das队列中的2例患者外(1例患者发生原发性植入失败,另1例患者发生血小板植入失败),几乎所有患者均实现中性粒细胞和血小板植入,中位植入时间分别为12天和12天 (表1)。
HSCT后的TKI维持治疗
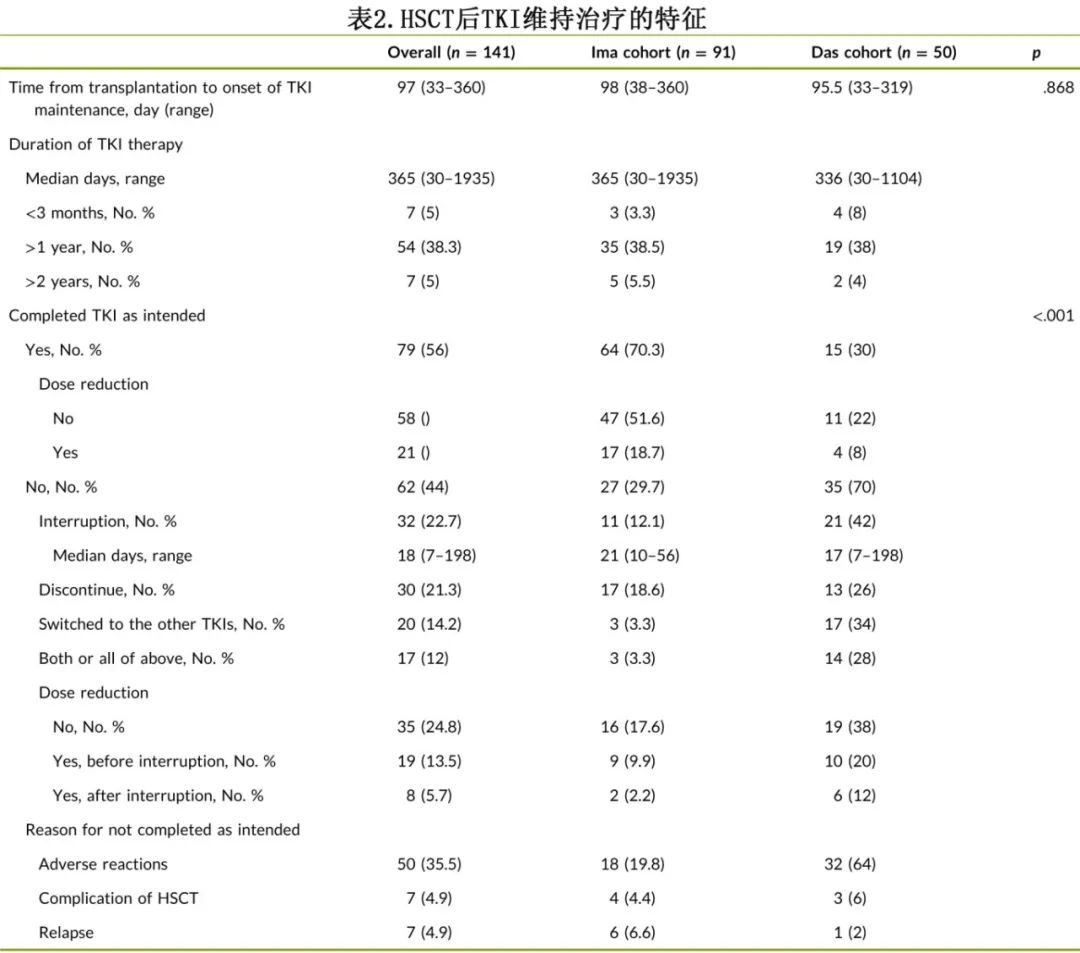
Ima组和Das组患者从移植至开始TKI维持治疗的中位时间分别为98天和95.5天。绝大多数患者接受TKI治疗>3个月,包括Ima组88例(96.7%),Das组46例(92%)。未按预期完成治疗的患者比例为44%,主要包括治疗中断、停药或转换为其他TKI, 且Das队列(70%)远高于Ima队列(29.7%)(p<0.001)。未按预期完成治疗的最常见原因为TKI治疗的不良反应,其他原因包括移植相关并发症和复发(血液学或分子生物学复发)。在减量方面,Ima队列中仅有47例患者接受足量伊马替尼治疗,28例患者减至300mg; Das队列中仅有11例患者接受足量达沙替尼治疗,20例患者减至50mg。HSCT后TKI维持治疗的详细信息见表2。
复发
中位随访50.6个月,Ima队列和Das 队列分别有15例和5例患者复发。Ima队列包括11例血液学复发、3例孤立性髓外复发[2例CNS和1例非CNS复发]和1例血液学伴CNS复发;8例在维持治疗期间,7例在随访期间。Das 队列包括2例血液学复发、1例多发髓外复发[CNS和非CNS均复发]、1例血液学伴非CNS髓外复发和1例血液学伴CNS复发)患者;3例在维持治疗期间,2例在随访期间。
Ima队列中16例患者(2例分子学复发,6例分子学复发后细胞学复发,8例分子学复发伴细胞学复发)和Das队列中10例患者(5例分子学复发,2例分子学复发后细胞学复发,3例分子学复发伴细胞学复发)可检测到BCR/ABL1融合转录本。Ima队列中7例患者出现ABL激酶突变,包括1例F317 L、1例Y253H、1例Y253H + T315 L和4例T315I突变,Das队列中4例BCR/ABL1阳性患者出现ABL激酶T315I突变。
复发后的治疗和结局
Ima队列中1例患者接受TKI单药治疗,而13例患者接受TKI之外的附加治疗,如供者淋巴细胞输注(DLI)、化疗、鞘内注射、放疗或二次allo - HSCT, 此外1例患者接受非TKI治疗。Das队列中3例接受TKI治疗、1例接受鞘内注射治疗、1例接受化疗联合DLI治疗。
除2例未经治疗的患者外,大多数患者在分子学复发后立即接受挽救治疗。最终,7例患者持续分子学缓解,而8例患者进展至血液学或髓外复发(4例死亡,4例仍存活)。12例直接细胞学复发的患者中有7例在接受治疗后死亡。所有死亡均发生于复发后2年内。分子学和细胞学均复发后的2年生存率为51.8%,而细胞学复发后的2年生存率仅为37.4%。
CIR、NRM和生存期
整个队列中11例患者死于疾病复发,5年时的CIR(累积复发率)为15.5%,5年时NRM(非复发死亡)的累积发生率为5.8%。3例死于感染,1例死于GVHD, 2例死于感染合并GVHD, 2例死于第二恶性肿瘤。Ima和Das队列的5年CIR和NRM率分别为16.1% vs 12.5% (p=0.82)和5.2% vs 9.8% (p=0.86)(图2C、D)。
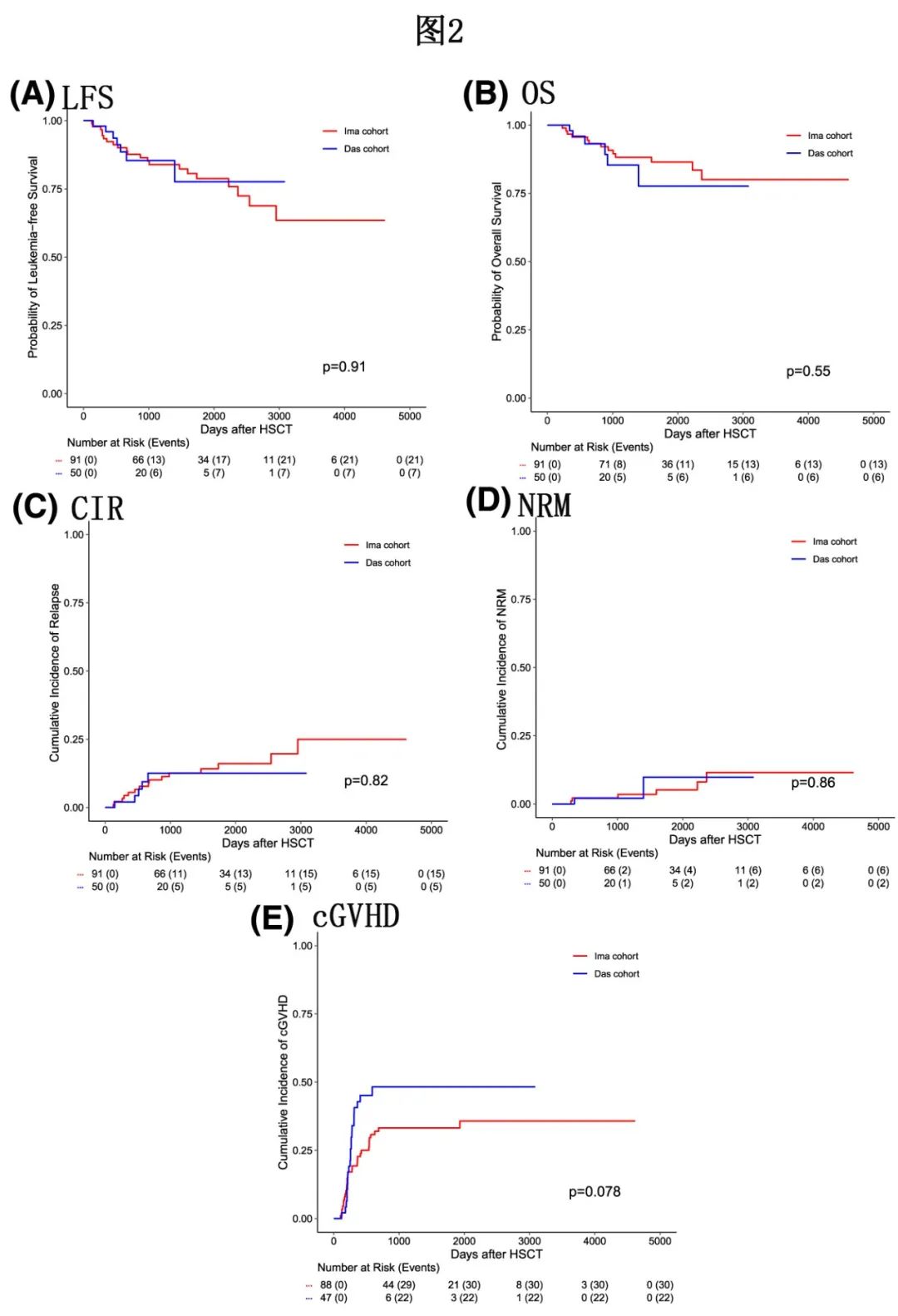
整个队列患者的5年LFS(无白血病生存率)和OS(总生存率)分别为78.6%和84.7%,且两队列的LFS和OS相似(Ima组的5年LFS为78.8%,Das组为77.6%,p=0.912;5年OS为86.5%和77.6%,p=0.545)(图2A、B)。在接受伊马替尼维持治疗的患者中,移植前MRD阴性和MRD阳性患者的疾病进展(p=0.6)或死亡(p=0.77)风险没有差异,Das队列中也出现类似结果(p=0.46,p=0.79)。
LFS和OS危险因素的单因素分析中,只有持续时间>1年与较好的LFS和OS相关。多因素分析显示,年龄和TKI治疗时间是LFS和OS的独立预后因素。
GVHD
Ima组和Das组2-4级aGVHD(急性移植物抗宿主病)的累积发生率分别为22%和28% (p=0.55),3-4级aGVHD累积发生率分别为12%和9.9% (p=0.62)。
5年cGVHD(慢性移植物抗宿主病)发生率为38.6%,中/重度cGVHD 5年累积发生率为16.03%,且伊马替尼组和达沙替尼组之间无显著差异;但Das组的5年轻度cGVHD发生率显著高于Ima组(37.3% vs 14.9%,p=0.03)(图2E为cGVHD的5年累积发生率)。
安全性
共133例患者纳入安全性分析,主要不良事件见表3。最常见的不良反应为中性粒细胞减少(66.4%),其发生率(64.7% vs 69.5%)和严重程度(3-4级为31.7% vs 34.7%)在Ima和Das队列中相似(p=0.156)。Ima组发生贫血45例(52.9%)和血小板减少28例(32.9%),Das组发生贫血29例(61.7%)和血小板减少17例(36.2%)。Ima组丙氨酸转氨酶升高27例(32.1%),天冬氨酸转氨酶升高21例(25%);Das组丙氨酸转氨酶升高18例(38.3%),天冬氨酸转氨酶升高15例(31.9%)。Das组消化道出血发生率较高(12例[25.5%] vs Ima组2例[2.3%],p<0.001),且消化道副作用较高(48.9% vs 31.4%);此外5例患者因消化道出血停用达沙替尼。

总结
该多中心回顾性分析显示,CR1期接受allo-HSCT的Ph+ ALL患者在接受伊马替尼预防与接受达沙替尼预防后的长期结局相当。选择伊马替尼作为维持治疗可达到更长的暴露时间,主要是因为其更好的耐受性。此外,接受TKI维持治疗的患者较既往研究有降低重度cGVHD发生率的趋势。
参考文献
Guan F, Yang L, Chen Y, et al.Comparison of long‐term outcomes between imatinib and dasatinib prophylaxis after allogeneic stem cell transplantation in patients with Philadelphia‐positive acute lymphoblastic leukemia: a multicenter retrospective study.Cancer. 2024;1‐11. doi:10.1002/cncr.35232
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#伊马替尼# #急性淋巴细胞白血病# #达沙替尼#
54