好文推荐 | 帕金森病睡眠障碍结构特征及其影响因素的临床研究
2024-04-24 中风与神经疾病杂志 中风与神经疾病杂志 发表于陕西省
探讨帕金森病(PD)患者睡眠障碍的发生率、睡眠结构特征、影响因素。
摘要
目的 探讨帕金森病(PD)患者睡眠障碍的发生率、睡眠结构特征、影响因素。方法 选取2016年8月—2022年4月就诊于河北医科大学第一医院神经内科门诊及住院的101例PD患者为研究对象。应用UPDRS-Ⅲ和H-Y分期对患者运动功能及疾病严重程度进行评价。对PD患者进行PSQI量表、ESS量表、IRLS量表、RBD量表等测试,并测量患者身高、体重、BMI、颈围、腹围、询问既往病史等,所有患者均接受了标准化的夜间多导睡眠监测。结果 (1)101例PD患者中有87例(86.14%)存在睡眠障碍。(2)PSG显示PD患者的睡眠障碍常见的有RBD、PLM和OSAHS。(3)PD-RBD患者REM期睡眠比例为(13.14±8.11)%,主观睡眠质量较差且伴有明显的抑郁情绪。(4)PD患者PLM易伴随RLS同时出现。(5)PD-OSAHS在颈围及腹围较大的PD患者中更易发生,与BMI值并无明显相关性,PD-OSAHS患者EDS更常见,对患者日间功能影响更大。结论 PD患者睡眠障碍的患病率较高,PD伴发睡眠障碍患者多表现为RBD、PLM和OSAHS等方面,PD-RBD患者睡眠质量较差且伴有明显的抑郁情绪,PD-OSAHS在颈围及腹围较大的PD患者中更易发生,与BMI值并无明显相关性。
帕金森病(PD)常见的神经系统退行性疾病,是一种增龄性疾病,65岁以上的老年人的患病率大约为1.7%,随着年龄增长,患病人数逐渐增加。通常认为PD是以复杂的运动症状为主要表现的运动障碍疾病,主要表现为运动迟缓、肢体僵硬、静止性震颤和姿势步态不稳。在过去的几十年中,帕金森病被确认为一种多层面的疾病,包括嗅觉减退、便秘、睡眠障碍、认知功能下降、自主神经功能紊乱、感觉异常等多种非运动症状。多种非运动症状早在临床确诊帕金森病之前就已经存在,并贯穿帕金森病的整个病程,一般随着运动症状的加重而加重。因PD的非运动症状严重影响患者的生活质量,近年来,PD的非运动症状越来越多受到人们的重视。研究显示,高达98%的帕金森病患者至少存在1种非运动症状,其中以睡眠障碍最为常见,如睡眠维持障碍、快速眼动睡眠期行为障碍(RBD)、不宁腿综合征(RLS)、周期性腿动(PLM)、白天过度嗜睡(EDS)、睡眠相关呼吸障碍(SBD)等,SBD以阻塞性睡眠呼吸暂停低通气综合征(OSAHS)为主。
本研究中PD患者均进行多导睡眠监测(PSG)及睡眠相关的问卷:Epworth睡眠量表(ESS)、匹兹堡睡眠质量指数(PSQI)、RBD筛查问卷(RBDSQ)和国际下肢不宁腿综合征评估量表(IRLS)的调查,通过比较分析PD伴发睡眠障碍患者的临床特点、睡眠结构特征及影响因素,希望能够对PD的睡眠障碍做出早期识别及干预。
1 资料与方法
1.1 临床资料
选取了河北医科大学第一医院101例PD患者为研究对象,就诊时间在2016年8月—2022年4月之间。记录所有PD患者的年龄、性别、教育程度、身高、体重、体重指数(BMI)、颈围、腹围、PD药物摄入量以及疾病严重程度。体重指数(BMI)用体重除以身高的平方计算。对以上人口学统计学资料进行分析,所有患者均在“开”期间接受检查。注意到使用了抗帕金森病药物,并计算了左旋多巴等效日剂量(LEDD)。疾病严重程度及运动功能评价采用Hoehn-Yahr分期和统一帕金森病评定量表第3部分(UPDRS-Ⅲ),并对所有的研究对象进行PSQI量表、ESS量表测试。
PD临床诊断采用2015年国际运动障碍协会(Movement Disorder Society,MDS)制定的原发性PD的诊断标准:首先符合帕金森综合征标准:(1)运动迟缓;(2)肌强直和/或静止性震颤(4~6 Hz)。
PD诊断确立的支持诊断标准(确诊PD需满足2条或以上):(1)单个肢体静止性震颤(既往或本次检查);(2)多巴胺能药物治疗疗效显著;(3)左旋多巴诱导的异动症;(4)存在嗅觉丧失或间碘苄胍(metaiodobenzylguanidine,MIBG)心肌显像提示存在心脏去交感神经支配。
PD警示征:(1)发病5年内出现快速进展的步态障碍,且需要规律使用轮椅;(2) 早期出现的球部功能障碍:发病5年内出现的严重的发音困难或构音障碍或严重的吞咽困难;(3)发病5年或5年以上,运动症状或体征完全没有进展,除非这种稳定是与治疗相关的;(4)在发病5年内出现严重的自主神经功能障碍,包括直立性低血压、尿潴留或尿失禁;(5)在发病3年内由于平衡损害导致的反复(>1次/年)摔倒;(6)吸气性呼吸功能障碍:白天或夜间吸气性喘鸣或者频繁的吸气性叹息;(7)发病10年内出现不成比例的颈部前倾(肌张力障碍)或手足挛缩;(8)双侧对称性的帕金森综合征;(9)即使是病程到了5年也不出现任何一种常见的非运动症状;(10)其他原因不能解释的锥体束征。
PD绝对排除标准:(1)采用多巴胺受体阻滞剂或多巴胺耗竭剂治疗,且剂量和时间过程与药物诱导的帕金森综合征一致;(2)向下的垂直性核上性凝视麻痹,或者选择性的向下垂直扫视减慢;(3)发病超过3年仍局限在下肢的帕金森综合征的表现;(4)明确的小脑异常;(5)尽管病情至少为中等严重程度,但对高剂量的左旋多巴治疗缺乏可观察到的疗效;(6)在发病的前5年内,诊断为很可能的行为变异型额颞叶痴呆或原发性进行性失语;(7)突触前多巴胺能系统功能神经影像学检查正常;(8)明确的皮层性的感觉丧失(出现皮肤书写觉和实体辨别觉损害),明确的肢体观念运动性失用或者进行性失语;(9)明确记录的可导致帕金森综合征或疑似与患者症状相关的其他疾病,或者专家认为可能为其他综合征,而不是PD。
临床确诊PD必须符合帕金森综合征,不具备PD排除标准,至少具备2条支持标准,且无警示征。
临床很可能的PD必须符合帕金森综合征,不具备PD排除标准,可以有2条及以下的警示征,且需更多的支持标准来抵消警示征。
对符合上述标准的患者记录包括:(1)年龄、性别、受教育年限、体重、身高、体重指数(BMI)、颈围、腹围、发病年龄、患病时间及服药剂量。(2)左旋多巴等效日剂量(LEDD)的计算:LEDD=(左旋多巴标准片×1+左旋多巴控释片×0.75)/(左旋多巴标准片×1+左旋多巴控释片×0.75)×1.33(同时服用恩他卡朋片)+吡贝地尔缓释片×1+盐酸普拉克索×100+盐酸罗匹尼罗×20+盐酸司来吉兰×10+盐酸雷沙吉兰×100+金刚烷胺×1。(3)对患者进行UPDRS-Ⅲ、H-Y分期、PSQI量表、ESS量表等测试。
1.2 帕金森病疾病严重程度及运动功能评定
1.2.1 应用帕金森病Hoehn-Yahr分级量表评估的严重程度
无疾病体征为0级;肢体受损仅限于单侧为1级;单侧肢体受损合并躯干症状为1.5级;双侧肢体受损但无平衡障碍为2级;轻度双侧肢体病变,平衡受损但后拉试验可以恢复为2.5级;轻至中度双侧肢体受损,后拉试验不能恢复,但仍可自理,姿势不稳,转弯变慢为3级;严重残疾,但不需要帮助仍能站立和行走为4级;坐轮椅或卧床,生活完全依赖他人帮助为5级。
1.2.2 应用统一帕金森病评定量表第3部分(UPDRS-Ⅲ)来评定患者的运动功能。
1.3 帕金森病伴发睡眠障碍的临床评估
采用匹兹堡睡眠质量指数量表(PSQI)、Epworth嗜睡量表(ESS)、国际不宁腿综合征评估量表(IRLS)评估患者的主观睡眠情况,PSG评估患者的客观失眠情况。
1.3.1 采用匹兹堡睡眠指数量表(PSQI)评估患者的睡眠质量
PSQI量表用于评定被试者最近1个月的睡眠质量。PSQI总分≤4分表示睡眠质量良好;5≤PSQI总分≤7分表示睡眠质量一般;PSQI总分≥8分则表示睡眠质量差(即睡眠障碍);PSQI总分越高表示睡眠质量越差,总分范围为0~21分。
1.3.2 采用Epworth嗜睡量表(ESS)评估患者日间嗜睡情况
ESS总分0~24分。得分>6分,说明瞌睡;得分>11分,说明非常瞌睡;得分>16分,说明有危险性的瞌睡。
1.3.3 采用国际不宁腿综合征评估量表(IRLS)评估患者不宁腿综合征严重程度
评分方法:非常重=4分;重度=3分;中度=2分;轻度=1分;无=0分。评估结果:0分为无症状;1~10分为轻微;21~30分为严重;31~40分为十分严重。
1.3.4 采用夜间多导睡眠监测(PSG)评估患者的睡眠结构。
1.4 情绪评估
1.4.1 焦虑情绪
采用汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)14项版本评估患者的焦虑状况。总分能较好地反应病情严重程度。<6分,则提示患者没有焦虑症状;≥7分,提示可能有焦虑;>14分,提示肯定有明显焦虑;>21分,提示肯定有焦虑;>29分,提示可能有严重焦虑症状。
1.4.2 抑郁情绪
采用汉密尔顿抑郁量表(Hamilton depression scale,HAMD)24项版本评估患者的抑郁状况。总分<8分,提示患者没有抑郁症状;8~19分,提示可能为轻度抑郁;20~34分,提示可能为中等程度的抑郁;>35分:提示可能为严重抑郁。
1.5 统计学分析
采用SPSS 25.0统计学软件,计数资料均以百分比表示,两组间比较采用χ2检验;计量资料先进行正态及方差齐性检验,符合正态分布且方差齐的以(x±s)表示,两组间比较采用独立样本t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 帕金森病患者人口学资料
PD患者共101例,男性45例(44.55%),女性56例(55.45%);年龄40~83岁,平均(66.07±6.56)岁;发病年龄39~72岁,平均(58.78±6.52)岁;患病时间0.5~16年,平均(6.42±3.48)年;BMI 16~30.2 kg/cm2,平均(25.22±3.05)kg/cm2;颈围30~46 cm,平均(37.34±5.33)cm;腹围75~111 cm,平均(95.42±11.02)cm;UPDRS-Ⅲ(开期)16~63分,平均(43.45±11.15)分;Hoehn-Hahr分期1~4分,平均(2.07±0.18);左旋多巴等效日剂量(LEDD)150~900 mg,平均(434.64±270.53)mg(见表1)。
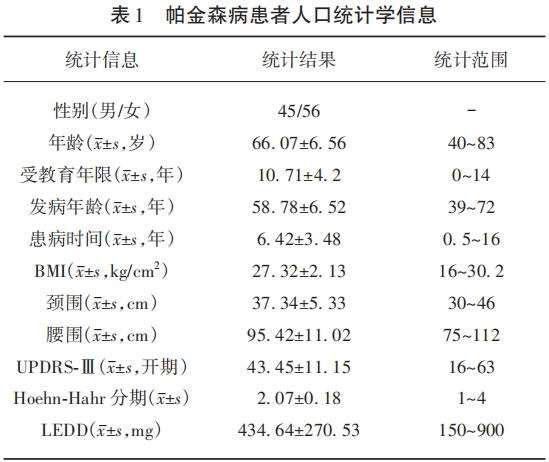
2.2 帕金森病患者睡眠障碍的分布情况
PSG结果显示101例PD患者中87例患者有睡眠障碍,占比为86.14%;PD-RBD患者26例,占比为25.74%;PD-PLM患者25例,占比为24.75%;PD-OSAHS患者17例,占比为16.83%;PD-RBD+PLM者8例,占比为7.92%;PD-OSAHS+PLM者6例,占比为5.94%;PD-RBD+OSAHS者3例,占比为2.97%;PD-RBD+OSAHS+PLM患者2例,占比为1.98%(见表2)。
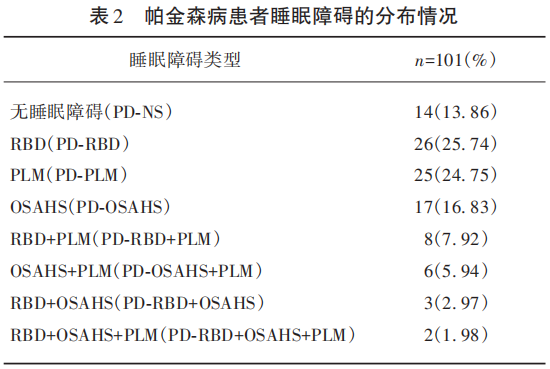
PSQI≥8分者71例,PD患者存在主观睡眠质量下降的比例为70.30%;ESS>6分者55例,占比为54.46%;PSQI≥8分且ESS>6分者43例,占比为42.57%。PSG显示患者睡眠障碍的发生率为86.14%。总之,PD患者伴发睡眠障碍的患病率较高。
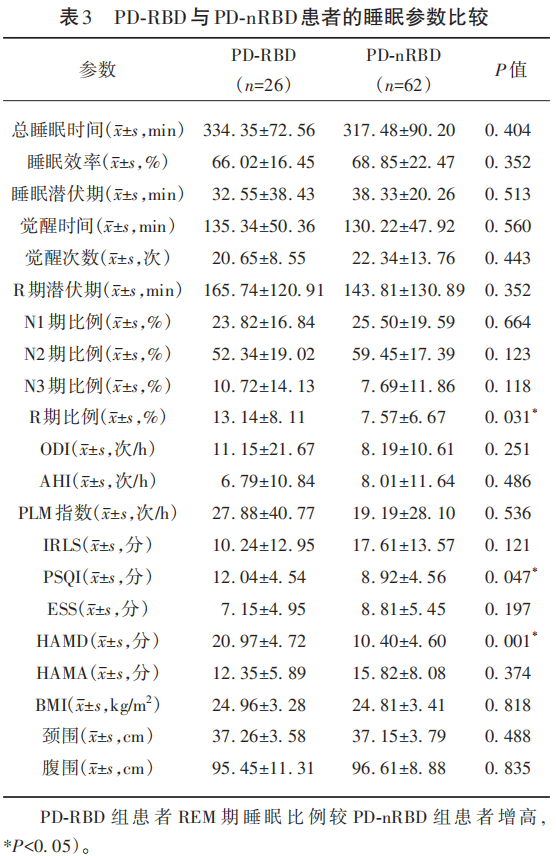
2.3 PSG显示PD-RBD与PD-nRBD患者的睡眠参数比较
PSG结果显示:PD-RBD组患者REM期睡眠比例较PD-nRBD组患者增高(P<0.05);PD-RBD组患者PSQI评分较PD-nRBD组患者高(P<0.05),患者主观睡眠质量较差;PD-RBD组患者HAMD评分较PD-nRBD组患者高(P<0.05)(见表3)。
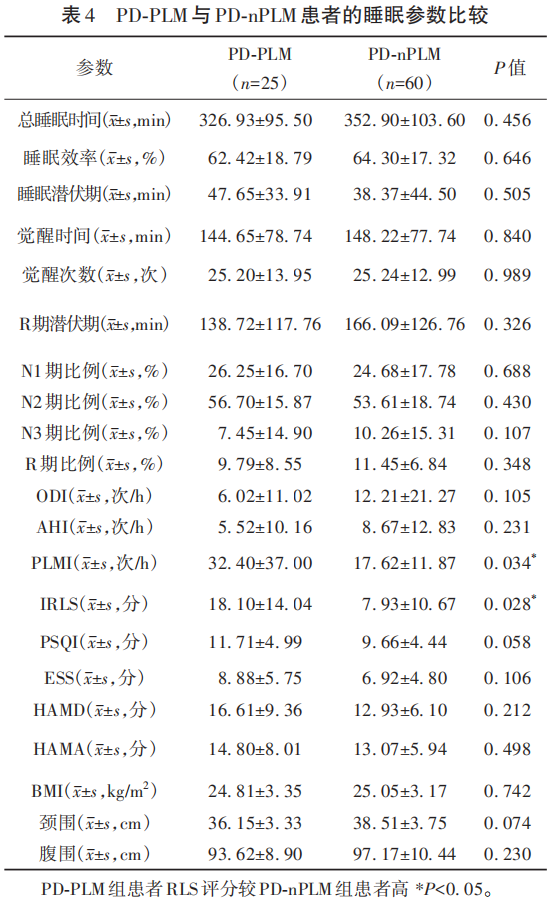
2.4 PSG显示PD-PLM与PD-nPLM患者的睡眠参数比较
PSG结果显示:PD-PLM组患者PLMI较PD-nPLM组患者增高(P<0.05);PD-PLM组患者RLS评分较PD-nPLM组患者高(P<0.05)(见表4)。
2.5 PSG监测显示PD-OSAHS与PD-nOSAHS患者的睡眠参数比较
PSG监测结果显示:PD-OSAHS组患者AHI指数较PD-nOSAHS组患者高(P<0.05);PD-OSAHS组患者PLMI较PD-nOSAHS组患者减低(P<0.05);PD-OSAHS组患者ESS评分较PD-nOSAHS组患者高(P<0.05),白日嗜睡症状明显;PD-OSAHS组患者颈围及腹围均较PD-nOSAHS组患者高(P<0.05)(见表5)。
3 讨 论
在正常生理状态下,睡眠从非快速眼动睡眠期(NREM)N1期的浅睡眠开始,快速进入N2期和N3期。N3期睡眠即为深睡眠期,脑电图(EEG)显示高振幅慢脉冲Δ波,因此通常被称为慢波睡眠(SWS)或者Δ波睡眠。之后再次进入N2期、N1期的浅睡眠阶段,然后再到快速眼动期(REM)睡眠。这是一个完整的睡眠循环周期,正常成年人一个睡眠周期大约90 min,每晚通常有4~6个睡眠周期循环。
睡眠障碍在帕金森病中很常见,严重影响患者的生活质量。睡眠障碍可以表现为运动前症状、疾病进展的一部分或治疗药物的副作用。此外,焦虑和抑郁并存会使睡眠恶化。运动症状,如震颤、强直和运动功能减退,在睡眠期间上述症状会减少,但不会完全消失,从而改变患者的睡眠质量,更差的睡眠质量会加重帕金森病的运动和非运动症状。大部分PD患者患有多种共病睡眠障碍,这大大降低了PD患者的生活质量。
帕金森病患者睡眠障碍是多因素的。先前确定的原因包括年龄增长、夜间运动症状、精神病并发症(如抑郁症和幻觉),以及可能扰乱睡眠结构并导致运动波动的药物作用。
遗传异质性在PD和PD的前驱期睡眠障碍(主要是RBD)的发展中起作用,有研究表明,PSG上较低的睡眠效率与年龄的增长和疾病的严重程度(Hoehn-Yahr分期和UPDRS)显著相关。这可能部分归因于由于疾病进展或帕金森病固有的渐进性睡眠破坏导致的夜间运动并发症恶化,如运动障碍、痉挛和肌张力障碍。
在本研究中,PSG显示的帕金森病患者睡眠障碍的总体患病率为86.14%,这与国际研究中报道的80%相似。睡眠障碍以RBD、PLM和OSAHS较为常见,而且部分患者共病2种甚至3种睡眠障碍。且本研究发现各类睡眠障碍患者的睡眠时间减少、睡眠效率低下、觉醒次数及觉醒时间均较高,提示PD患者睡眠维持障碍明显。在本研究队列中38.61%的PD患者发现RBD,这与以前的报告基本一致,通过问卷调查或访谈评估的PD患者RBD的频率在15%~45%之间,但当进行PSG时,RBD的患病率在36%~58%之间,一项比较有RBD和无RBD帕金森病患者的研究报告指出,RBD与年龄较大、病程较长和左旋多巴剂量较高有关。本研究发现,PD-RBD患者REM期睡眠比例增高,PSQI评分较高,主观睡眠质量较差且伴有明显的抑郁情绪。
RBD的发生通常与不愉快的梦境行为有关,而梦境通常与患者的心理状态有关。RBD已被证明是迄今为止PD预测因子中似然比最高的因素,RBD与PD均被认为是进展中的α-共核蛋白病。抑郁也被确认为PD的临床前驱症状标志物,而且研究发现,抑郁有多种神经递质变化和临床表现与RBD相关。抑郁可导致快速眼动睡眠中断。已有研究发现,在抑郁症患者的健康亲属中RBD可以预测抑郁的发生。本研究显示PD患者RBD发生率较高,且与抑郁相关,与之前的研究结论一致,也表明RBD与抑郁可能有共同潜在的病理机制。
本研究显示,有40.59%的PD患者PSG观察到PLM。这也与其他研究报告相似。其他研究中报告PLM的风险因素包括年龄和疾病严重程度;然而,这些因素都与williamhill asia 样本中PLM的频率无关。与PD相关的多导睡眠参数紊乱包括睡眠效率差、N3睡眠量减少和R睡眠减少。在本研究的患者中,N3睡眠总量很低,但由于N3随着年龄的增长而减少,因此不被认为是一个临床上有意义的发现。本研究发现与PD-PLM患者IRLS评分明显高于PD-nPLM患者。RLS表现为患者通常伴有不舒服和不愉快的腿部感觉,而且有要移动腿的冲动,活动后症状可减轻,这些症状往往出现在休息时或晚上入睡前。RLS可能很难从类似的临床疾病中区分出来,而且目前RLS诊断主要依靠患者主观评估,没有精准的客观诊断手段。有研究发现,周期性腿动在 RLS患者中的患病率较高。有学者认为,PLM与RLS是一种共病现象。本研究结果与此相似。
OSAHS属于睡眠相关的呼吸障碍,是最常见的呼吸相关疾病之一,OSAHS在PD患者中的患病率估计在20%~60%左右。在本研究对象中,54%的患者观察到OSAHS,颈围、腰围是其相关危险因素,BMI指数并没有明显地增高,这在PD中得到了越来越多的认可。这并不奇怪,因为PD-OSAHS患者并没有明显的肥胖。重要的是,PD-OSAHS患者白日嗜睡症状明显,ESS评分与PD-nOSAHS患者相比有显著性差异。目前研究已证实OSAHS对患者日间症状和与健康相关的生活质量有严重的不利影响,还有可能增加PD患者惊恐障碍的风险。且有研究指出,OSAHS可能导致帕金森病纹状体多巴胺转运体利用度降低,PD和OSAHS之间可能存在双向关系。因此,除了对PD睡眠障碍相关症状的关注外,williamhill asia 还应该关注PD睡眠障碍对患者日间生活质量的影响,以求达到改善睡眠及日间生活质量的共同目的。
总之,帕金森病患者中PSG量化睡眠障碍的患病率很高,williamhill asia 样本中PD患者常见的睡眠障碍有睡眠维持障碍、RBD、PLM和OSAHS。PD患者合并抑郁似乎是RBD的危险因素。PD患者PLM易伴随RLS同时出现。OSAHS患者的颈围及腹围更大,并不与BMI指数相关。EDS在OSAHS患者中明显更常见。本研究存在一定的局限性。首先,本研究系样本量偏小,没有进行多中心研究,下一步研究需要更大的样本量加以证实;其次,本部分研究未能将治疗不同种类帕金森病药物对睡眠结构的影响纳入研究。
参考文献
[1]Zhang ZX,Roman GC,Hong Z,et al. Parkinson's disease in China: prevalence in Beijing,Xian,and Shanghai[J]. Lancet,2005,365(9459):595-597.
[2]Liu CF,Wang T,Zhan SQ,et al. Management recommendations on sleep disturbance of patients with Parkinson's disease[J]. Chin Med J,2018,131(24):2976-2985.
[3]Chahine LM,Amara AW,Videnovic A. A systematic review of the literature on disorders of sleep and wakefulness in Parkinson's disease from 2005 to 2015[J]. Sleep Med Rev,2017,35: 33-50.
[4]Mitchell SL,Harper DW,Lau A,et al. Patterns of outcome measurement in Parkinson's disease clinical trials[J]. Neuroepidemiology,2000,19(2):100-108.
[5]Postuma RB,Berg D,Stern M,et al. MDS clinical diagnostic criteria for Parkinson's disease[J]. Mov Disord,2015,30(12):1591-1601.
[6]Tomlinson CL,Stowe R,Patel S,et al. Systematic review of levodopa dose equivalency reporting in Parkinson's disease[J]. Mov Disord,2010,25(15):2649-2653.
[7]Qu Y,Chen YP,Li JT,et al. Worse sleep quality aggravates the motor and non-motor symptoms in Parkinson's disease[J]. Front Aging Neurosci,2022,14: 887094.
[8]Zhang Y,Zhao JH,Huang DY,et al. Multiple comorbid sleep disorders adversely affect quality of life in Parkinson's disease patients[J]. NPJ Parkinsons Dis,2020,6: 25.
[9]Larsen JP,Tandberg E. Sleep disorders in patients with Parkinson's disease: epidemiology and management[J]. CNS Drugs,2001,15(4):267-275.
[10]Garcia-Borreguero D,Larrosa O,Bravo M. Parkinson's disease and sleep[J]. Sleep Med Rev,2003,7(2):115-129.
[11]Happe S,Schrödl B,Faltl M,et al. Sleep disorders and depression in patients with Parkinson's disease[J]. Acta Neurol Scand,2001,104(5):275-280.
[12]Diederich NJ,Vaillant M,Mancuso G,et al. Progressive sleep 'destructuring' in Parkinson's disease. A polysomnographic study in 46 patients[J]. Sleep Med,2005,6(4):313-318.
[13]Dhawan V,Healy DG,Pal S,et al. Sleep-related problems of Parkinson's disease[J]. Age Ageing,2006,35(3):220-228.
[14]Huang J,Cheng Y,Li C,et al. Genetic heterogeneity on sleep disorders in Parkinson's disease: a systematic review and meta-analysis[J]. Transl Neurodegener,2022,11(1):21.
[15]Suzuki K,Miyamoto M,Miyamoto T,et al. Sleep disturbances associated with Parkinson's disease[J]. Parkinsons Dis,2011,2011: 219056.
[16]Norlinah MI,Afidah KN,Noradina AT,et al. Sleep disturbances in Malaysian patients with Parkinson's disease using polysomnography and PDSS[J]. Parkinsonism Relat Disord,2009,15(9):670-674.
[17]Gagnon JF,Bédard MA,Fantini ML,et al. REM sleep behavior disorder and REM sleep without atonia in Parkinson's disease[J]. Neurology,2002,59(4):585-589.
[18]Iranzo A,Santamaría J,Rye DB,et al. Characteristics of idiopathic REM sleep behavior disorder and that associated with MSA and PD[J]. Neurology,2005,65(2):247-252.
[19]Postuma RB,Berg D. Advances in markers of prodromal Parkinson disease[J]. Nat Rev Neurol,2016,12(11):622-634.
[20]Ghazi Sherbaf F,Rahmani F,Jooyandeh SM,et al. Microstructural changes in patients with Parkinson disease and REM sleep behavior disorder: depressive symptoms versus non-depressed[J]. Acta Neurol Belg,2018,118(3):415-421.
[21]Boeve BF,Silber MH,Ferman TJ,et al. Clinicopathologic correlations in 172 cases of rapid eye movement sleep behavior disorder with or without a coexisting neurologic disorder[J]. Sleep Med,2013,14(8):754-762.
[22]Berg D,Postuma RB,Adler CH,et al. MDS research criteria for prodromal Parkinson's disease[J]. Mov Disord,2015,30(12):1600-1611.
[23]Murphy MJ,Peterson MJ. Sleep disturbances in depression[J]. Sleep Med Clin,2015,10(1):17-23.
[24]Giles DE,Roffwarg HP,Rush AJ. A cross-pal study of the effects of depression on REM latency[J]. Biol Psychiatry,1990,28(8):697-704.
[25]Modell S,Lauer CJ. Rapid eye movement (REM) sleep: an endophenotype for depression[J]. Curr Psychiatry Rep,2007,9(6):480-485.
[26]Grandas F,Iranzo A. Nocturnal problems occurring in Parkinson's disease[J]. Neurology,2004,63(8 Suppl 3):S8-S11.
[27]Covassin N,Neikrug AB,Liu L,et al. Clinical correlates of periodic limb movements in sleep in Parkinson's disease[J]. J Neurol Sci,2012,316(1-2):131-136.
[28]Chaudhuri KR,Healy DG,Schapira AHV,et al. Non-motor symptoms of Parkinson's disease: diagnosis and management[J]. Lancet Neurol,2006,5(3):235-245.
[29]Iranzo A,Valldeoriola F,Santamaría J,et al. Sleep symptoms and polysomnographic architecture in advanced Parkinson's disease after chronic bilateral subthalamic stimulation[J]. J Neurol Neurosurg Psychiatry,2002,72(5):661-664.
[30]Gupta MA,Simpson FC,Lyons DCA. The effect of treating obstructive sleep apnea with positive airway pressure on depression and other subjective symptoms: a systematic review and meta-analysis[J]. Sleep Med Rev,2016,28: 55-68.
[31]Cuellar NG,Strumpf NE,Ratcliffe SJ. Symptoms of restless legs syndrome in older adults: outcomes on sleep quality,sleepiness,fatigue,depression,and quality of life[J]. J Am Geriatr Soc,2007,55(9):1387-1392.
[32]Szentkiralyi A,Völzke H,Hoffmann W,et al. The relationship between depressive symptoms and restless legs syndrome in two prospective cohort studies[J]. Psychosom Med,2013,75(4):359-365.
[33]Kjelsberg FN,Ruud EA,Stavem K. Predictors of symptoms of anxiety and depression in obstructive sleep apnea[J]. Sleep Med,2005,6(4):341-346.
[34]Santamaria J,Iranzo A,Montserrat JM,et al. Persistent sleepiness in CPAP treated obstructive sleep apnea patients: evaluation and treatment[J]. Sleep Med Rev,2007,11(3):195-207.
[35]Chen Y,Gao Y,Sun X,et al. Association between sleep factors and Parkinson's disease: a prospective study based on 409,923 UK biobank participants[J]. Neuroepidemiology,2023,57(5):293-303.
[36]Oh YS,Kim JS,Lyoo CH,et al. Obstructive sleep apnea and striatal dopamine availability in Parkinson's disease[J]. Mov Disord,2023,38(6):1068-1076.
[37]Jeon SH,Hwang YS,Oh SY,et al. Bidirectional association between Parkinson's disease and obstructive sleep apnea: a cohort study[J]. J Clin Sleep Med,2023,19(9):1615-1623.
作者信息
基金项目:河北省卫健委跟踪项目(GZ2023067);河北省卫健委一般项目(20231041);河北医科大学第一医院星火科研项目(XH202201); 河北省重点研发计划项目(20377721D)
作者单位:1.河北医科大学第一医院(首都医科大学宣武医院河北医院)神经内科,河北 石家庄 050031;2.河北省脑老化与认知神经科学实验室,河北省神经医学技术创新中心,河北 石家庄 050031;3.河北医科大学第一医院眼科,河北 石家庄 050031
通信作者:顾平,E-mail:gpwh2000@126.com
引证本文
刘惠苗,李艳敏,张永志,等.帕金森病睡眠障碍结构特征及其影响因素的临床研究[J].中风与神经疾病杂志,2024,41(3):209-214.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















#帕金森病# #睡眠障碍# #睡眠结构特征#
39