Dev Cell:科学家发现PRC1在遗传错误和癌症中发挥作用
2020-07-28 佚名 免疫细胞研究bioworld
PRC1在细胞分裂过程中起着“粘胶”的作用,可以精确地控制单个细胞分裂过程中两组DNA分离的速度。这一发现可以解释为什么太多或太少的PRC1会破坏该过程并导致与癌症有关的基因组错误。
背对细胞分裂至关重要的蛋白质PRC1过量,是许多癌症类型(包括前列腺癌,卵巢癌和乳腺癌)中的一个明显迹象。近几天发表在《Developmental Cell》上的一项新研究表明,PRC1在细胞分裂过程中起着“粘胶”的作用,可以精确地控制单个细胞分裂过程中两组DNA分离的速度。这一发现可以解释为什么太多或太少的PRC1会破坏该过程并导致与癌症有关的基因组错误。PRC1产生粘性摩擦力,阻力随速度而增加。它产生的摩擦力与水的摩擦力类似。在DNA,运动蛋白和微管的本质上,生物学从物理学中汲取了线索。在细胞分裂的有丝分裂阶段,单个细胞必须将其DNA复制到两个相同的集合中,然后快速有效地将该DNA分离成两个新的子细胞。这是一种物理行为,而做到这一点的细胞结构即有丝分裂纺锤体,是一种利用机械力(推,拉和阻力)完成任务的机器。
科研人员认为,PRC1产生的力是随着DNA分离而整合并抑制细胞运动,从而最终获得正确的染色体分离率。但是,如果该过程出错,则细胞最终会使用错误的说明手册进行工作,这可能导致癌症无法控制的生长。
重点:
1,有丝分裂交联蛋白PRC1的集合产生摩擦力
2,抗微管滑动鳞片与灯丝速度成线性关系
3,摩擦力与PRC1数成比例,但不重叠长度或PRC1密度
4,PRC1充当粘性阻尼器,调节分裂细胞中的微管速度
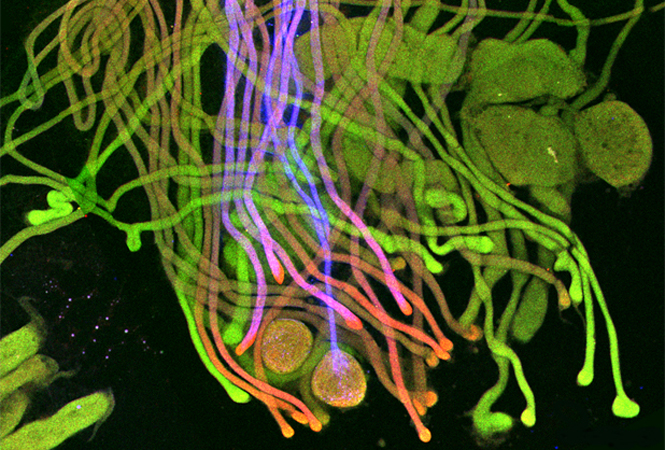
真核生物中的细胞分裂需要纺锤体设备的调节组装。纺锤体内微管的正确组织是由运动蛋白驱动的,该蛋白施加力使细丝滑动,而非运动蛋白将细丝交联成更高阶的基序,例如重叠的束。尚不清楚主动和被动力如何集成以在主轴内产生调节的机械输出。在这里,科研人员采用同时光学捕获和全内反射荧光(TIRF)显微镜直接测量由有丝分裂交联蛋白PRC1产生的抵抗微管滑动的摩擦力。这些力与微管滑动速度和PRC1交联的数量成比例,但不取决于重叠长度或重叠内的PRC1密度。结果表明,PRC1的作用类似于机械阻尼器,产生了对快速运动的显着抵抗,但对慢动作的抵抗却最小,从而将各种运动活动整合为一个机械结果。
Forth实验室检查由细胞结构成分(如有丝分裂纺锤体)施加的物理力。纺锤体是由两个中心体在两个新近形成且希望相同的染色体组集中在细胞中心附近的相对侧上形成的。密集的微管网络从中心体延伸,形成围绕并连接染色体的笼子。然后,在数百万种蛋白质和运动蛋白的帮助下,微管开始缩短并滑动,将染色体拉向中心体,直到将两组分离。
PRC1是一种“交联剂”,一种长而有弹性的分子,其两端均带有一个头,沿其长度连接两个微管。在有丝分裂纺锤体中心附近,大量的PRC1将微管群链接成束。
Forth的小组在实验室中创建了微管滑动机构的受控版本,并使用光学捕获技术来测量在微管之间滑动的PRC1的摩擦力。光学捕获依赖于紧密聚焦的激光束,该激光束会吸引附着在微管上的物体(在这种情况下为微型聚苯乙烯珠)。研究人员使用激光束拉珠子(类似于科幻小说中的“牵引束”),并在珠子抵抗陷阱的拉动时将折射光的转换转换为直接的力。
该团队还用荧光分子标记了PRC1,使他们能够观察到微管被拉开时其移动和分布。他们使用全内反射荧光显微镜来收集实验图像,同时记录力。
Forth和他的同事发现,随着越来越多的蛋白质被添加到系统中,随着微管运动的加快,它们会遇到更大的阻力。本质上,PRC1的行为就像将单元格固定在一起的胶水。就像许多生物过程一样,如果没有这种蛋白质,那细胞就麻烦了,因为细胞分裂时会失败。细胞内所有东西都粘合在一起,这可能就是这种蛋白质与癌症的联系方式。在健康的细胞分裂中,有一个平衡点,那就是正确,精确地控制速率的适量。
研究局限性:研究的局限性在于是否存在其他非运动蛋白已捆绑并聚集纺锤体或动粒微管,例如NuMA或HURP,并产生类似的粘性力来抵抗微管滑动,或者是否采用了其他机制,这些仍有待阐明。
该研究揭示了生物学基本机制的内部运作方式,提供了使williamhill asia 更好地战胜癌症的知识。这是一项精心设计的精美研究,其结果为将来的抗癌策略奠定了基础。该文数据显示,PRC1分子的集合体可以产生抵抗相对微管滑动的阻力。这些力的大小与滑动速率和接合交联的总数成正比,但与交联剂的密度或重叠长度无关。阻力对滑动速度的线性比例依赖性表明,PRC1团表现为粘性交联剂。停止滑动后,阻力会放松,而恢复滑动会导致阻力大于初始滑动事件。最后,研究人员提出了一个简单的定量模型,通过引入允许微管末端充当抵抗PRC1扩散的部分反射性屏障的参数,概括了数据的关键特征。文章最后阐明了PRC1分子集合体可以调节分裂细胞内微管运动速度的机制。
原始出处:
Ignas Gaska 1, Mason E Armstrong 1, April Alfieri 1, et al.The Mitotic Crosslinking Protein PRC1 Acts Like a Mechanical Dashpot to Resist Microtubule Sliding.Dev Cell. 2020 Jun 30;S1534-5807(20)30496-2. doi: 10.1016/j.devcel.2020.06.017.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言









#PRC1#
54
#Cell#
42
#科学家发现#
55
#Dev#
65
#CEL#
57