STAT蛋白在癌症中的作用
2023-04-15 小药说药 网络 发表于上海
STAT蛋白——尤其是STAT3、STAT5和STAT6,以及STAT1——在协调癌细胞代谢的多个方面发挥着重要作用。
信号转导和转录激活物(STAT)蛋白家族包括STAT1、STAT2、STAT3、STAT4、STAT5(STAT5A和STAT5B)和STAT6。在癌症中,STAT蛋白,特别是STAT3和STAT5,作为细胞因子、生长因子及其受体和肿瘤细胞中过表达的其他分子转导信号,同时在转录水平和表观遗传水平上调节大量基因的表达。这些基因参与肿瘤细胞增殖、抑制细胞凋亡、促进癌细胞干化和耐药性。
STAT蛋白(尤其是STAT3)直接和间接调节癌细胞中的各种代谢相关过程,包括有氧糖酵解、氧化磷酸化、活性氧(ROS)产生、线粒体能量生成、线粒体膜完整性调节、谷氨酰胺代谢、脂质合成和脂质分解代谢。STAT蛋白还调节肿瘤微环境中免疫细胞的代谢,以诱导免疫抑制和肿瘤细胞侵袭。因此,STAT蛋白的代谢重编程作用对肿瘤生长、抗癌免疫和疾病进展具有深远影响。STAT蛋白已成为逆转多种癌症类型代谢失调的潜在有价值的靶点。
在正常细胞中,ATP和生物合成前体通过糖酵解和氧化代谢途径产生。以往研究发现,即使在氧气存在的情况下,癌细胞也会转向有氧糖酵解,而不是呼吸氧化磷酸化,以支持其快速增殖,这一现象被称为“Warburg效应”。癌细胞还可以利用氧化代谢通过线粒体中脂肪酸和氨基酸的氧化产生ATP。STAT蛋白在癌细胞中的氧糖酵解和呼吸氧化代谢中发挥重要作用。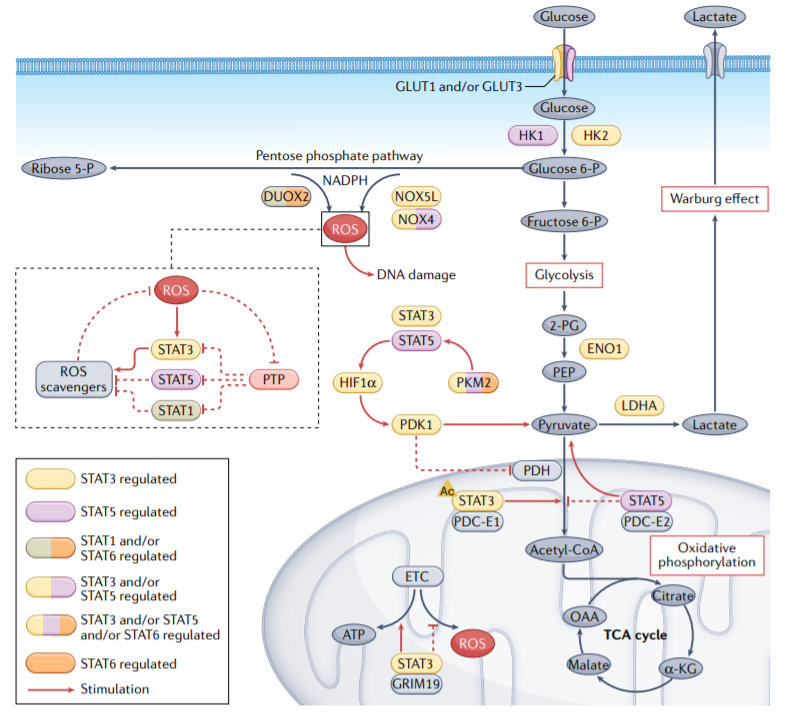
STAT3、STAT5和STAT6调节葡萄糖转运蛋白和一些酶类,如葡萄糖转运蛋白1(GLUT1)和GLUT3、己糖激酶2(HK2)、烯醇化酶1(ENO1)、丙酮酸激酶M2(PKM2)和乳酸脱氢酶A(LDHA)的表达和活性,它们对癌细胞的葡萄糖代谢至关重要。反过来,PKM2也促进STAT3和STAT5信号传导,STAT5激活缺氧诱导因子1α(HIF1α),导致癌细胞糖酵解的进一步上调。
磷酸戊糖代谢途径是糖酵解途径的一个分支,产生NADPH和5-磷酸核糖。NADPH氧化酶(NOX)将电子从NADPH转移到氧,从而产生ROS。免疫调节细胞因子促进双氧化酶2(DUOX2)的上调,通过STAT1和STAT6信号通路导致ROS和DNA损伤的积累。ROS激活Janus激酶2(JAK2–STAT3)信号和STAT5,STAT5上调NOX4和NOX5L以产生更多ROS,增加肿瘤细胞的生长和增殖。
除了调节Warburg效应外,线粒体STAT3还促进氧化磷酸化和线粒体电子运输链(ETC)活性。STAT3与细胞死亡调节蛋白GRIM19的相互作用可能促进STAT3向线粒体的易位。一旦进入线粒体,STAT3与ETC复合物I和II相互作用,导致ROS水平降低。STAT3的乙酰化也可能通过STAT3与丙酮酸脱氢酶复合物(PDC)亚基E1(PDC-E1)的相互作用促进线粒体能量调节。PDC是一种连接糖酵解和三羧酸(TCA)循环的线粒体酶,STAT3与PDC的结合加速丙酮酸进入TCA循环,并进一步增加癌细胞中ATP的合成。
此外,STAT5还通过增加HIF1α的水平来促进Warburg效应,HIF1α驱动丙酮酸脱氢酶激酶亚型1(PDK1)的产生,从而阻止丙酮酸进入TCA循环,并将代谢转移到乳酸产生。此外,磷酸化的STAT5与线粒体中的PDC-E2相互作用,激活STAT5介导的转录,并促进代谢从氧化磷酸化转变为有氧糖酵解。
烟酰胺腺嘌呤二核苷酸(NAD+)是氧化磷酸化氧化还原反应中的一种辅酶,对能量代谢至关重要。NAD+水平随着人类年龄的增长而降低,其与癌症发病率的增加有关。NAD+水平降低会触发IL-6分泌,从而激活STAT3信号,促进致癌转化和癌细胞干性化。
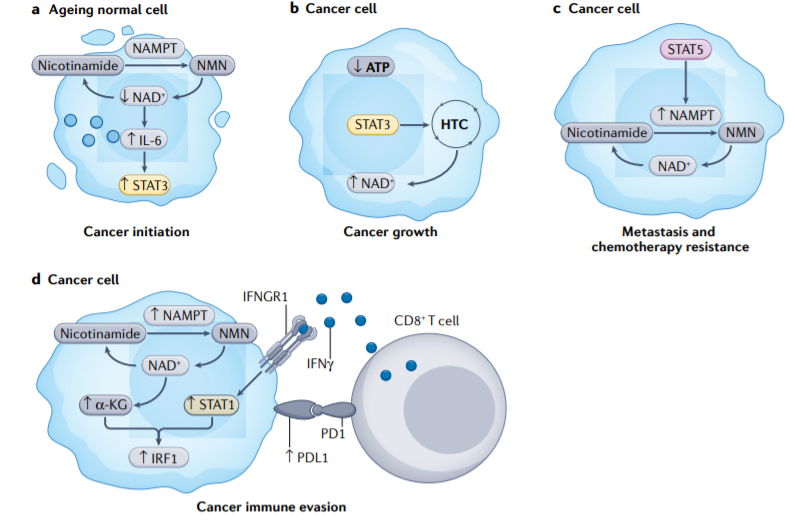
在一些癌细胞中,线粒体受损,ATP生产受损。为了弥补能量不足,STAT3诱导产生氢化物转移复合物(HTC),该复合物催化代谢循环,将氢化物阴离子从NADH转移到NADP+,从而再生NAD+并供应NADPH。在携带BRAFV600E突变的黑色素瘤细胞中,STAT5诱导NAMPT(烟酰胺磷酸核糖转移酶)的表达,这有助于维持NAD+水平。同时,STAT5诱导的NAMPT将黑色素瘤细胞转向与靶向治疗耐药相关的侵袭表型。
除了促进NAD+生物发生外,癌细胞中NAMPT的表达增加了α-酮戊二酸(α-KG)水平,导致程序性细胞死亡配体1(PD-L1)通过STAT1依赖性IFN-γ途径上调。因此,癌细胞中NAMPT表达的升高和NAD+代谢的上调抑制了CD8+T细胞依赖性细胞毒性。
脂质合成和脂质分解代谢都在肿瘤发生和治疗抵抗中起着至关重要的作用。癌细胞有效地合成脂质并从肿瘤微环境中输入脂质,并对脂肪组织分泌的脂肪因子、细胞因子和生长因子做出反应。STAT蛋白不仅增加脂质合成和分解代谢,还增加肿瘤细胞的脂质输入,STAT蛋白在多个水平上调节癌症促进脂质代谢。

STAT3和STAT5上调脂肪酸结合蛋白(FABPs)和CD36(脂质转运蛋白),导致脂质积聚增加,这支持肿瘤细胞的转移潜力。HER2介导的STAT3激活转录上调脂肪酸合成酶(FASN),这导致从头脂肪酸合成增加。STAT5还上调对脂肪生成重要的其他酶,包括乙酰辅酶A羧化酶1(ACC1)和甾醇调节元件结合蛋白1(SREBP1)。癌细胞的转移潜能与磷脂水平升高和三酰甘油水平降低相关。
肿瘤坏死因子诱导蛋白8样蛋白3(TIPE3)也通过激活STAT3促进肺癌的发生,STAT3激活也与磷脂酰胆碱水平升高和三酰甘油水平降低有关。STAT6通过miR-197–叉头盒蛋白J2(FOXJ2)轴抑制胆固醇合成,从而减少内质网(ER)应激和肺癌进展。
脂肪酸β-氧化(FAO)等脂质分解代谢途径对于将脂肪酸转化为肿瘤细胞生长和进展的能量来源是不可或缺的。FAO因其在癌症进展、化疗耐药性和癌症干细胞(CSC)维持方面的新作用而备受关注。FAO活性在许多类型的CSC中,以及在化疗耐药和放疗耐药的癌细胞中上调,STAT3介导的FAO限速酶肉碱O-棕榈酰转移酶1,肌肉亚型(CPT1-M)的转录上调对乳腺癌干细胞和化疗耐药细胞中的FAO上调至关重要。一项研究调查了FAO介导的乳腺癌细胞化疗耐药性的潜在机制,结果表明,FAO通过乙酰化激活STAT3,激活的STAT3转录上调ACSL4(长链酰基CoA合成酶4)的表达。这种酶增强磷脂合成,导致线粒体膜中磷脂含量增加,从而提高线粒体完整性。因此,线粒体凋亡途径变得无效,从而阻止化疗诱导的肿瘤细胞凋亡。此外,STAT3还直接调节LPL(脂蛋白脂酶)的表达,从而促进慢性淋巴细胞白血病细胞的存活。
肿瘤细胞周围的脂肪组织还分泌脂肪酸、脂肪因子、细胞因子和/或激素(包括leptin、IL-6、VEGF和IL-8)。白色脂肪组织和肿瘤相关脂肪细胞释放的IL-6和leptin水平与STAT3的旁分泌激活相关,STAT3驱动乳腺癌转移、癌细胞干化和化疗耐药性。
除了代谢葡萄糖和脂质外,癌细胞还表现出对谷氨酰胺代谢的依赖,以促进增殖、存活和侵袭。这种谷氨酰胺依赖型癌细胞经历代谢重编程,通过TCA循环驱动谷氨酰胺的利用。STAT蛋白除了通过转录调节促进谷氨酰胺代谢外,参与谷氨酰胺代谢途径的多种酶和受体还通过STAT信号的作用促进细胞增殖、细胞周期进展、上皮间质转化,在癌症进展中发挥重要作用。
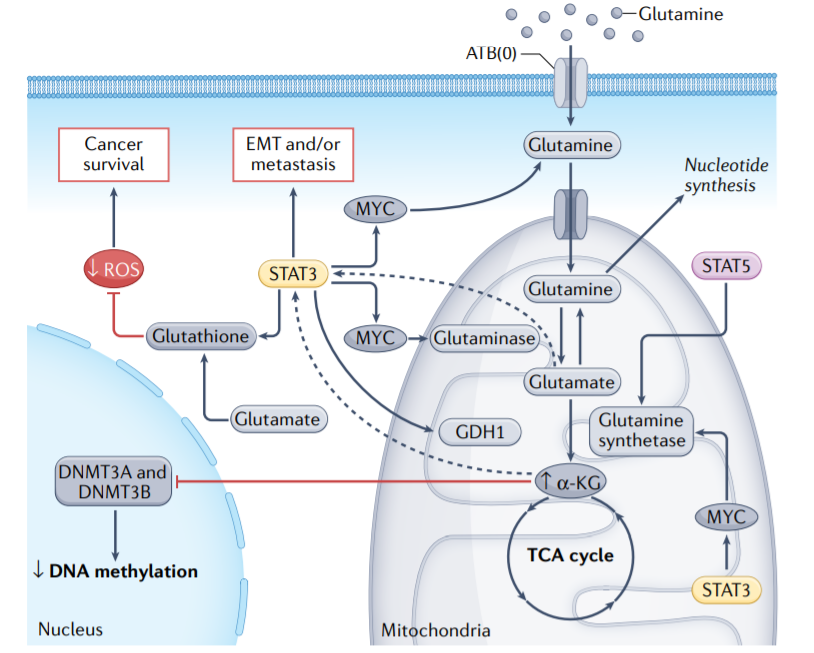
许多癌细胞(包括非小细胞肺癌、乳腺癌和头颈癌细胞)高度依赖谷氨酰胺以促进其生长和生存,并表现出谷氨酰胺转运体的上调。STAT蛋白转录调控癌细胞中参与谷氨酰胺代谢的几种分子:STAT3通过MYC上调ATB(0),ATB(0)介导的谷氨酰胺摄取维持癌细胞中谷氨酰胺、谷胱甘肽和多种三羧酸循环代谢产物的高细胞内水平。谷氨酰胺一旦进入肿瘤细胞,就会转化为谷氨酸并激活谷氨酰胺酶,谷氨酰胺酶是谷氨酰胺分解的限速酶,在某些癌症中被上调。激活的STAT3直接增加编码谷氨酰胺酶的GLS1的表达。
有趣的是,STAT3还上调了关键的ROS清除剂谷胱甘肽,从而保持ROS水平。阻断STAT3抑制谷胱甘肽的产生,导致ROS介导的肿瘤细胞凋亡。此外,MYC和STAT5上调谷氨酰胺合成酶,后者催化谷氨酸转化为谷氨酰胺。这种代谢改变导致核苷酸的产生增加,这与肿瘤细胞的放射治疗耐药性有关。此外,谷氨酰胺和谷氨酰胺代谢酶也通过增加STAT3活性或水平促进癌症进展。
谷氨酸通过谷氨酸脱氢酶1(GDH1)或各种氨基转移酶脱氨基为α-酮戊二酸(α-KG),产生L-氨基酸。GDH1活性在结直肠癌及其转移性病变中升高,这与STAT3介导的上皮间质转化(EMT)相关。最后,STAT3信号可以通过上调线粒体中的α-KG来控制细胞核中的DNA甲基化,由此产生的DNA甲基化异常提供了对核基因表达的表观遗传控制。
越来越多的证据证明STAT蛋白在调节肿瘤相关免疫细胞中的糖酵解、氧化磷酸化、ROS产生、脂质代谢、FAO和谷氨酰胺解中发挥重要作用,这些变化也影响抗肿瘤免疫反应。STAT3、STAT5和STAT6介导肿瘤微环境中免疫细胞的代谢重编程,这增加了免疫抑制细胞类型的积累,特别是髓源性抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs),STAT蛋白还重编程肿瘤微环境中效应T细胞和自然杀伤(NK)细胞的代谢,这些变化以不同方式对其抗肿瘤功能产生积极和消极影响。
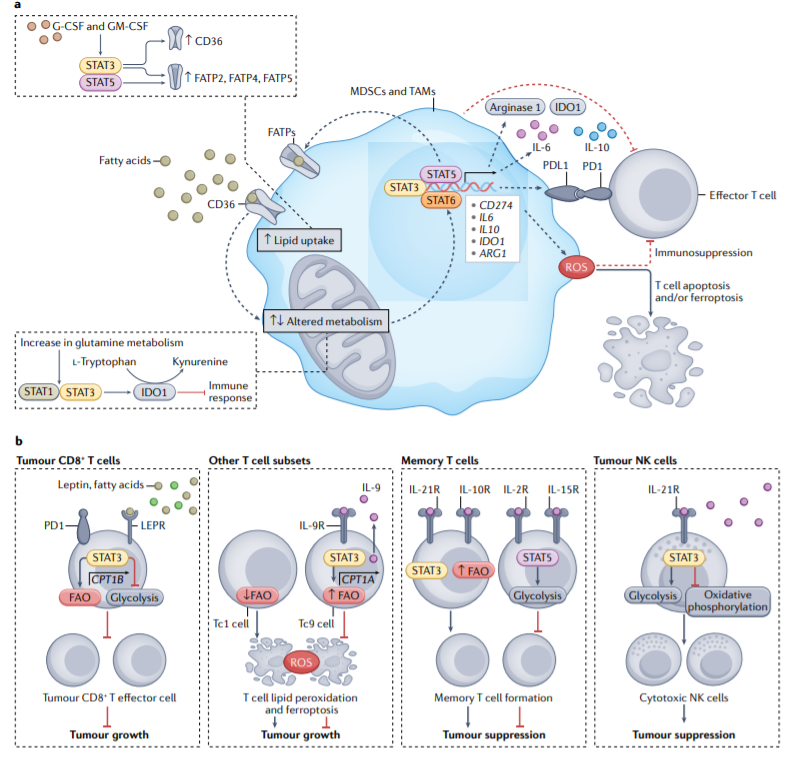
STAT蛋白诱导代谢重组,这对MDSCs和TAMs的免疫抑制功能很重要。STAT蛋白有助于产生多种免疫抑制因子,包括PD-L1、IL-10、IL-6、IDO1。此外,STAT3、STAT5和STAT1调节ROS水平,ROS可诱导T细胞凋亡和/或铁死亡,并抑制T细胞功能。
粒细胞集落刺激因子(G-CSF)和粒细胞-巨噬细胞集落刺激因素(GM-CSF)分别激活STAT3和STAT5,以上调长链脂肪酸转运蛋白2(FATP2)、FATP4和FATP5。这些FATPs和CD36的上调增强了脂质摄取,这促进了MDSCs和TAM的免疫抑制作用。
MDSCs中增强的谷氨酰胺裂解对癌症免疫抑制也很重要。事实上,阻断MDSC中的谷氨酰胺代谢会下调pSTAT3和pSTAT1,从而减少STAT3调控的下游基因的表达,包括IL-10和IDO1。
尽管STAT蛋白介导的MDSCs和TAMs中ROS、脂质摄取、脂肪酸氧化和谷氨酰胺代谢的上调通常促进免疫抑制,但CD8+T细胞中STAT蛋白同样介导的代谢变化可具有抑癌和促癌作用。例如,STAT3通过增强FAO活性来抑制CD8+T细胞效应器功能。然而,IL-9诱导的STAT3活性增加和FAO保护Tc9 T细胞免受ROS诱导的铁死亡,并增强其抗肿瘤作用。此外,FAO对于记忆T细胞的形成始终是必要的,这在抗肿瘤免疫中很重要。然而,STAT介导的糖酵解上调在T细胞抗肿瘤功能中具有相反的作用。此外,尽管需要更多的研究来解决这些明显的矛盾,但STAT3介导的NK细胞的Warburg效应可能对NK细胞的抗肿瘤功能至关重要。
代谢的重编程是公认的癌症进展、治疗抵抗和免疫抑制的驱动因素。大量证据表明,STAT蛋白——尤其是STAT3、STAT5和STAT6,以及STAT1——在协调癌细胞代谢的多个方面发挥着重要作用。
STAT蛋白介导的代谢改变影响癌细胞和多种肿瘤相关免疫细胞。引人注目的是,肿瘤微环境中肿瘤细胞或免疫细胞的相同代谢变化可能对癌症进展产生类似或相反的影响。例如STAT3在肿瘤微环境中的阻断部分通过促进糖酵解的增加而增强了T细胞的扩增和肿瘤的浸润,但通过STAT3介导的糖酵解增加以及氧化磷酸化的减少,NK细胞的增殖能力及其抗肿瘤作用都大大增加。因此,由于其在通过多种机制促进癌细胞存活、侵袭、治疗抵抗和免疫抑制方面的重要作用,以STAT3或STAT5为靶点的抗癌治疗有望产生有益的临床效果。
参考文献:
1.STAT proteins in cancer: orchestration of metabolism. Nat Rev Cancer.2023 Jan 3.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言