JACC-BTS 同济大学彭文辉/庄剑辉教授团队揭示模式识别受体NLRC5对心肌重构的改善作用及机制
2023-07-27 论道心血管 论道心血管 发表于上海
该研究揭示巨噬细胞来源的模式识别受体NLRC5通过与热休克蛋白家族成员HSPA8相互作用,抑制巨噬细胞中IL-6释放,并改善心肌重构和心力衰竭的机制,为心力衰竭的免疫调节治疗提供新思路。
单纯针对心肌重构的心肌细胞损伤治疗并不能完全改善甚至逆转心力衰竭的进展。近年来研究发现,巨噬细胞在心肌重构的微环境中发挥轴心作用,而巨噬细胞和模式识别受体也逐渐成为改善心肌重构的新兴治疗靶点。
2023年1月18日,同济大学附属第十人民医院彭文辉/庄剑辉教授团队在JACC: Basic to Translational Science上发表题为“Macrophage-specific NLRC5 Protects from Cardiac Remodeling through Interaction with HSPA8”的研究论文。该研究揭示巨噬细胞来源的模式识别受体NLRC5通过与热休克蛋白家族成员HSPA8相互作用,抑制巨噬细胞中IL-6释放,并改善心肌重构和心力衰竭的机制,为心力衰竭的免疫调节治疗提供新思路。

首先,研究者在肥厚性心肌病合并心衰的患者外周血单核细胞、心脏组织和主动脉缩窄(TAC)构建的小鼠心衰组织、心脏巨噬细胞中发现模式识别受体NLR家族的NLRC5表达显著升高(图1)。
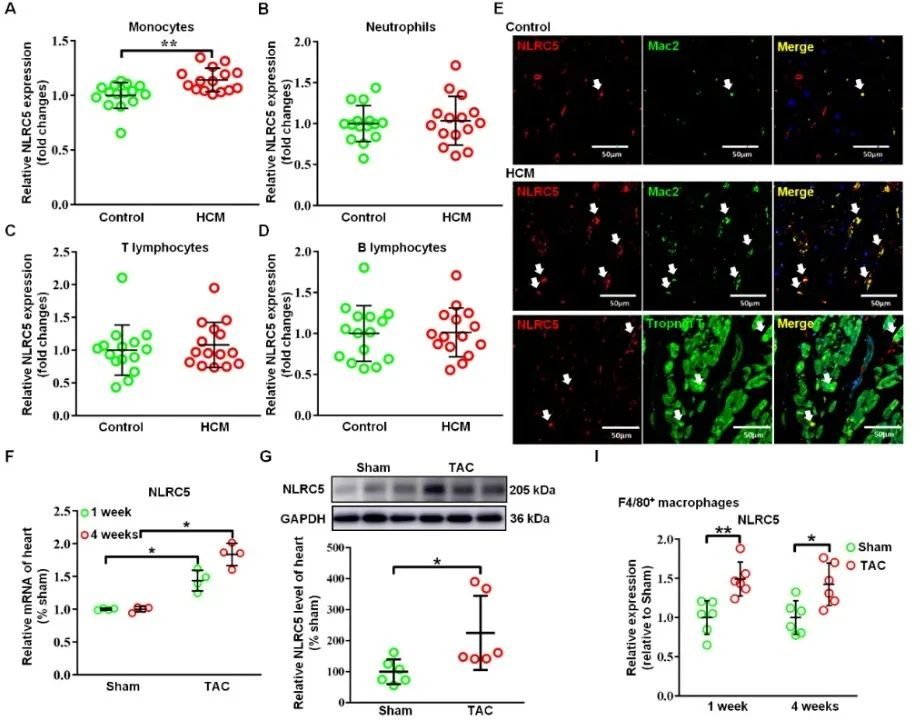
图1. 心力衰竭患者和小鼠的单核巨噬细胞中NLRC5表达显著升高
为了进一步明确髓系来源巨噬细胞中NLRC5对心肌重构的作用,研究者通过骨髓移植和髓系特异性敲除NLRC5小鼠等方法,揭示巨噬细胞NLRC5缺失加重TAC小鼠的心肌重构和心力衰竭,并促进心脏CCR2+TIMD4-巨噬细胞和中性粒细胞的浸润。随后,联合高效液相色谱质谱、免疫共沉淀和细胞因子芯片,研究者证实巨噬细胞中NLRC5与热休克蛋白HSPA8结合,调控巨噬细胞中IL-6的分泌(图2)。
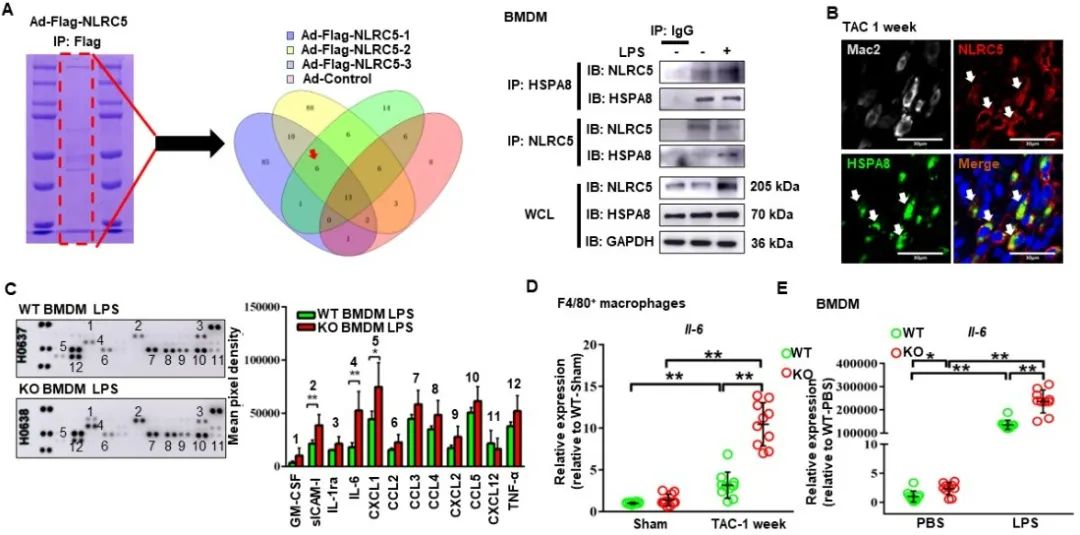
图2. 巨噬细胞中NLRC5与HSPA8相结合调控IL-6分泌
综上所述,本研究发现巨噬细胞模式识别受体NLRC5与热休克蛋白HSPA8结合,调控IL-6释放,并通过STAT3磷酸化影响心肌细胞肥大和成纤维细胞增殖及活化,证实了NLRC5在心肌重构和心力衰竭中发挥关键调节作用。此外,IL-6受体拮抗剂托珠单抗(Tocilizumab)显著逆转NLRC5缺失造成的心肌肥厚和心力衰竭,表明托珠单抗可能成为治疗心力衰竭的新策略。
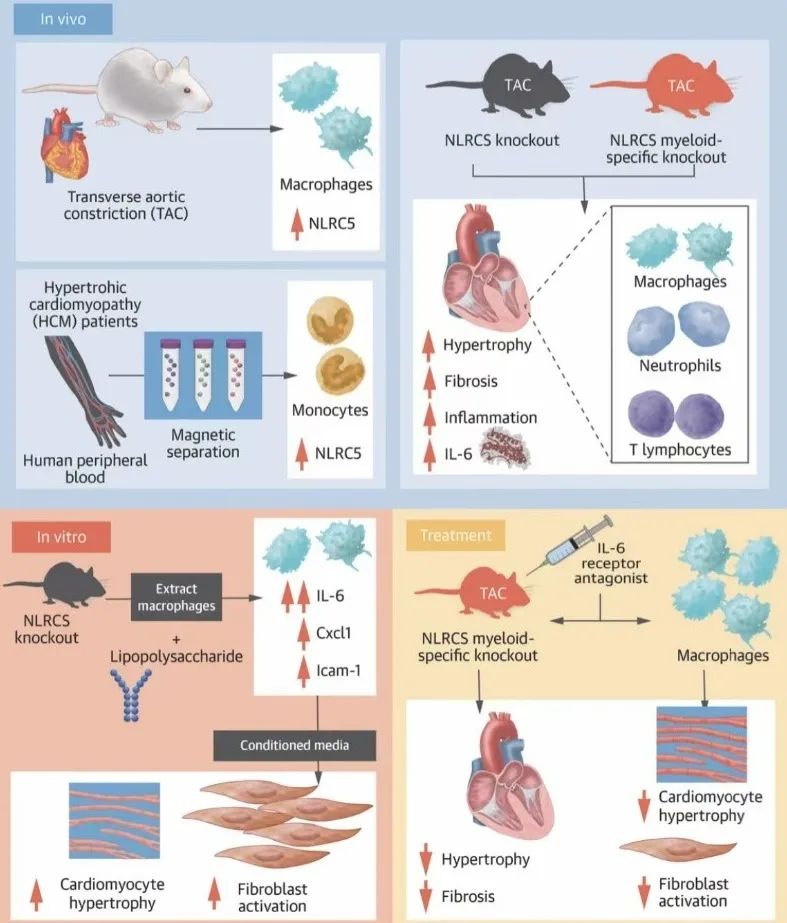
图3. NLRC5通过调控IL-6的分泌影响心肌重构的进展和机制
同济大学附属第十人民医院彭文辉教授和庄剑辉教授为本文的共同通讯作者,同济大学泛血管研究所研究助理俞晴和博士研究生鞠沛楠为本文的共同第一作者。该工作得到哈佛医学院Mark W. Feinberg教授、同济大学附属第十人民医院徐亚伟教授和张毅教授的大力支持。
同济大学附属第十人民医院彭文辉/庄剑辉教授团队长期从事心血管重构的免疫调控和转化研究。近年来系统研究NLRC5蛋白在心血管疾病中的作用,研究成果发表在Nature Communications、Theranostics、FASEB J等杂志。
原文链接:
https://www.jacc.org/doi/10.1016/j.jacbts.2022.10.001
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言