Lancet Neurol:Tau蛋白单克隆抗体Tilavonemab对进行性核上性麻痹治疗无效!
2021-02-22 MedSci原创 MedSci原创
进行性核上性麻痹是一种与tau蛋白聚集相关的神经退行性疾病。
进行性核上性麻痹是一种与tau蛋白聚集相关的神经退行性疾病。Tilavonemab(ABBV-8E12)是一种与人tau蛋白N端结合的单克隆抗体。本研究评估Tilavonemab治疗进行性核上性麻痹的安全性和有效性。
这是一项在澳大利亚、加拿大、法国、德国、意大利、日本、西班牙和美国的66家医院和诊所中开展的随机、安慰剂对照、双盲的2期研究。招募≥40岁确诊或疑诊发生了进行性核上性麻痹的受试者,且要求症状出现时间不到5年,有可靠的研究伙伴,能够在最小限度的帮助下步行5步。受试者被随机分至三组(1:1:1),分别在第1、15和29天静脉注射Tilavonemab2000 mg、4000 mg或匹配的安慰剂,然后每28天重复给药一次,共25周。主要终点是意向治疗人群中进行性核上性瘫痪评定量表(PSPRS)总分的变化。
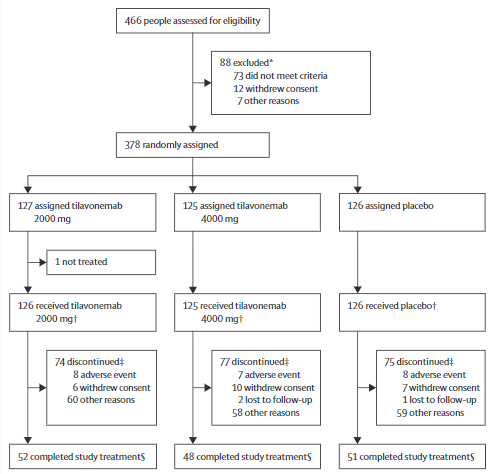
研究流程
2016年12月12日-2018年12月31日期间,共有378位患者被随机分组。因第二次中期分析符合预先指定的无效标准,该研究于2019年7月3日终止。
治疗前后PSPRS的变化
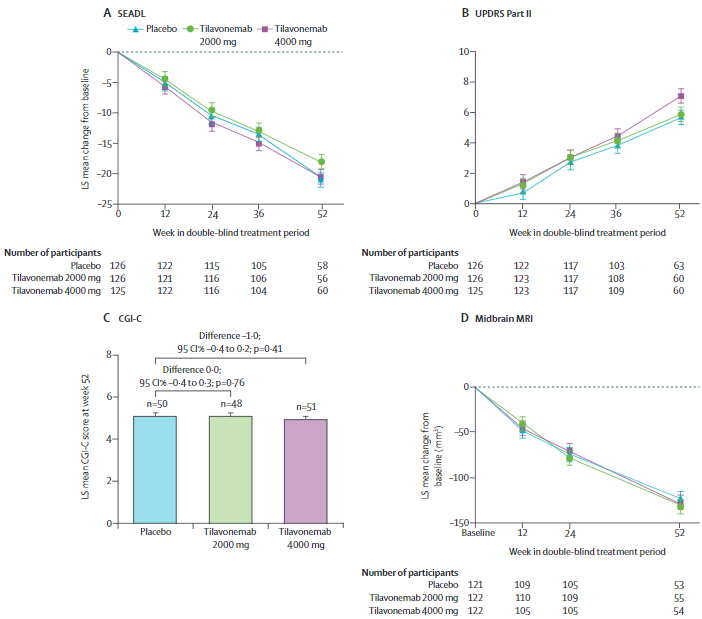
共有377名受试者至少接受了一剂研究药物,被纳入疗效和安全性分析(2000 mg组,n=126;4000 mg组,n=125;安慰剂组,n=126)。从基线到第52周,各组PSPRS的最小二乘均值变化相近(与安慰剂相比的组间差异:2000 mg组 0.0[95%CI-2.6~2.6],效应大小为0.000,p>0.99;4000 mg组 1.0[-1.6~3.6],-0.105,p=0.46)。
治疗前后次要终点的变化
大多数受试者报告了至少一次不良事件(2000mg组 111例[88%];4000 mg组 111例[89%];安慰剂组108例[86%])。跌倒是最常见的不良反应(2000 mg组 42例[33%];4000 mg组 54例[43%];安慰剂组 49例[39%]),还是最常见的紧急治疗严重不良事件(4% vs 5% vs 5%)。各组严重不良事件的发生率相似(23% vs 27% vs 26%)。研究期间发生了26例死亡(2000 mg组 9例[7%];4000 mg组 9例[7%];安慰剂组 8例[6%]),但无一例与药物有关。
综上所述,在本研究的所有治疗组中都观察到相似的安全性特征。未记录到有益的治疗效果。虽然这项研究没有提供Tilavonemab用于进行性核上性麻痹有疗效的证据,但这些发现为未来使用tau抗体被动免疫治疗进行性核上性瘫痪提供了潜在的有用信息。
原始出处:
Hoglinger Günter U,Litvan Irene,Mendonca Nuno et al. Safety and efficacy of tilavonemab in progressive supranuclear palsy: a phase 2, randomised, placebo-controlled trial. Lancet Neurol, 2021, 20: 182-192.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













#Neurol#
53
#mAb#
51
#Lancet#
56
#克隆#
58
#进行性#
63
#EMA#
45
#Tau#
0
#进行性核上性麻痹#
53
顶刊就是不一样,质量很高,内容精彩!学到很多
84
好文章!
102