罗详冲:EGFR基因共突变晚期 NSCLC 患者一线治疗策略最全总结
3小时前 医悦汇 医悦汇 发表于上海
本期「专家组稿」由北京大学肿瘤医院云南医院李高峰教授担任执行主编,与曲靖市第二人民医院心胸外科罗详冲医生共同分享《EGFR基因共突变晚期NSCLC患者一线治疗策略最全总结》,为医者和患者提供更多参考。
编者按:目前EGFR-TKIs显著改善了EGFR敏感突变晚期NSCLC患者的治疗格局,EGFR-TKIs单药已成为EGFR突变晚期NSCLC患者的一线标准选择。但随着基因检测技术如二代测序(NGS)水平的提高,除EGFR基因突变外,合并有其他基因突变的患者越来越多的被检出。目前对于EGFR共突变NSCLC患者的治疗存在一些争议,威廉亚洲博彩公司 也未对EGFR阳性合并共突变患者的治疗做出规范化推荐。研究表明,部分EGFR共突变对肺癌的生物学行为有重要影响,同时对EGFR-TKI单药的疗效有明显影响,对于EGFR阳性合并共突变NSCLC患者的治疗选择仍然是临床中的难题。
本期「专家组稿」由北京大学肿瘤医院云南医院李高峰教授担任执行主编,与曲靖市第二人民医院心胸外科罗详冲医生共同分享《EGFR基因共突变晚期NSCLC患者一线治疗策略最全总结》,为医者和患者提供更多参考。
一、EGFR与TP53共突变
TP53基因是一种位于17号染色体短臂17p13.1上的抑癌基因,参与调节DNA损伤与修复,诱导细胞凋亡与衰老,抑制肿瘤的发生发展以及肿瘤血管形成等过程[1]。在NSCLC患者中,TP53突变是EGFR最常见共突变类型,约50%~65%的EGFR突变阳性患者中可检测到TP53共突变。TP53的突变包括错义、沉默、框架转换(插入与删除)及无意义突变,其中错义突变为TP53最常见突变类型,其多发生于外显子5-8[2](图1)。TP53突变部位在不同类型的EGFR突变中不同,TP53外显子5突变常发生于EGFR 21外显子L861Q的患者中,而TP53外显子7突变则常发生于在EGFR外显子19del的患者中[3]。
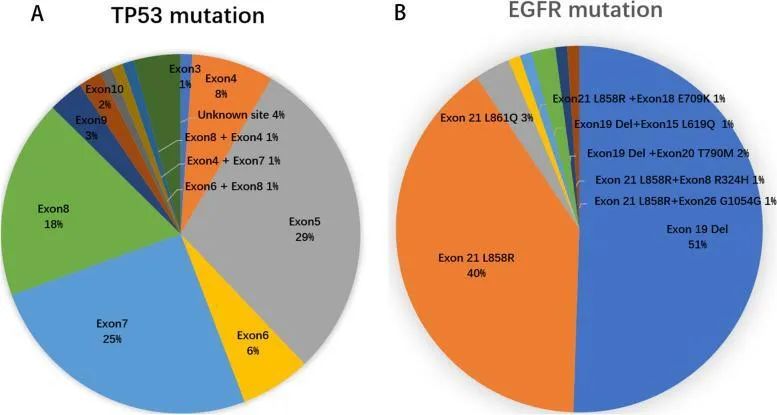
图1[2]:(ATP53突变图和(B)EGFR突变位点在共突变患者中的分布
研究表明[4],与TP53野生型相比,合并TP53突变的EGFR阳性NSCLC患者显示出更短的PFS和OS,且会降低NSCLC患者接受EGFR-TKIs的治疗疗效,预后不佳(图2)。造成EGFR与TP53共突变靶向治疗效果不佳的原因为容易发生小细胞肺癌(SCLC)转化和介导EGFR-TKIs获得性耐药的发生等[5]。
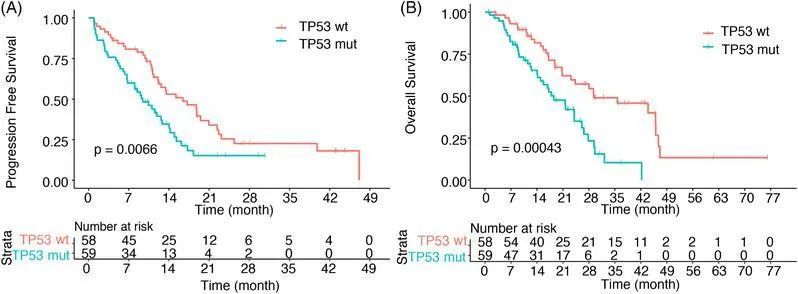
图2[4]:EGFR/TP53共突变患者接受EGFR-TKIs治疗的PFS和OS
研究发现,对于EGFR与TP53共突变的NSCLC患者更优的治疗策略为联合治疗,而非单药EGFR-TKI治疗。联合治疗策略可选择如下:
①靶向联合化疗:基于FLAURA2研究的惊艳数据证实了奥希替尼联合化疗治疗EGFR敏感突变晚期NSCLC患者明显优于单药奥希替尼治疗,为共突变及预后差的靶向治疗探索带来启发。一项回顾性研究纳入95例EGFR/TP53共突变患者[6],结果显示,与EGFR-TKIs单药相比,EGFR-TKIs联合化疗可显著改善EGFR/TP53共突变晚期NSCLC患者的ORR和TTP,联合治疗组和EGFR-TKIs单药组的ORR和TTP分别为 55.9%和34.4%(P<0.05)以及16.1个月和11.1个月(P<0.05)。与此同时,多项类似临床研究都验证了EGFR-TKIs联合化疗可显著改善EGFR与TP53共突变患者的临床获益,靶向联合化疗可作为EGFR与TP53共突变患者的潜在治疗选择[7-8],期待大样本的前瞻性临床研究。
②靶向联合抗血管生成药物:ACTIVE研究证实了阿帕替尼+吉非替尼可改善EGFR与TP53共突变患者的PFS[9];RELAY研究证实了雷莫芦单抗+厄洛替尼可提升EGFR与TP53共突变患者的PFS和DOR[10];ALTER-L004研究证实了埃克替尼+安罗替尼可提高EGFR与TP53共突变患者的ORR和DCR[11]。由此可见,靶向联合抗血管生成药物有望成为EGFR与TP53共突变患者治疗的新选择,也是未来需要继续探索的方向。
③免疫治疗:研究表明,TP53突变的肿瘤显著高表达PD-L1,且肿瘤突变负荷(TMB)和拷贝数变异负荷(CNA)均升高,高表达PD-L1和EGFR与TP53共突变显著相关,而单独的EGFR突变与高PD-L1表达无关,这解释了为什么仅具有EGFR突变的晚期NSCLC患者对免疫治疗反应不佳,而EGFR/TP53共突变的患者可能受益于抗PD-1/PD-L1治疗。多项临床研究也显示,EGFR/TP53共突变的NSCLC患者可以从免疫治疗中获益[12]。
二、EGFR与PIK3CA共突变
PIK3CA基因位于染色体3q26.3上,含有20个外显子,其突变可激活下游PI3K/AKT/mTOR信号通路而介导肺癌的发生与发展。研究表明[13-14],PIK3CA在NSCLC中突变概率约2-5%,其中肺鳞癌突变概率大于肺腺癌。PIK3CA突变主要发生在外显子9(E545K、E545Q、E545G、E545A、Q546R、E542K和T536I)和外显子20(H1047R、H1047L、M1043L、G1007R和Y1021C)(图3),其中E545K和H1047R是最常见的突变位点。研究已证实,在NSCLC中PIK3CA突变常与其他致癌驱动因子突变共存,尤其是EGFR和KRAS,EGFR与PIK3CA共突变概率约3.5%[13]。
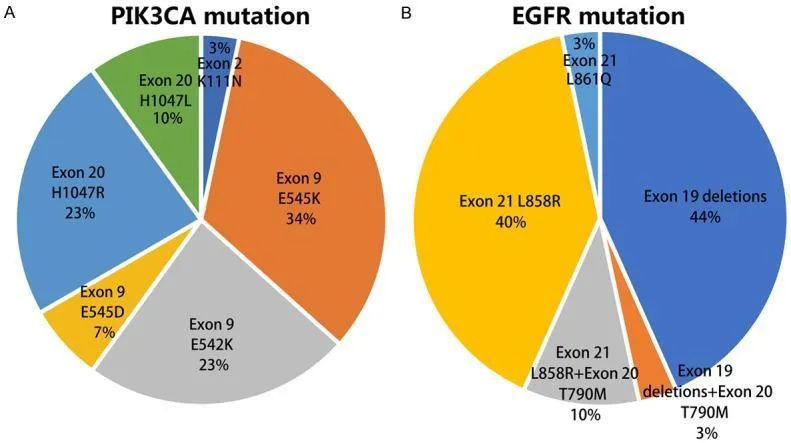
图3[14]:(A)PIK3CA突变和(B)EGFR突变位点在共突变患者中的分布
值得注意的是,PIK3CA突变已被证实是导致肺癌患者对EGFR-TKIs耐药的机制之一。多项回顾性研究表明[14-15],相对于EGFR单突变,EGFR与PIK3CA共突变的NSCLC患者接受EGFR-TKIs治疗的PFS和OS更短,预后更差(图4),但目前仍缺乏大样本前瞻性临床证实。
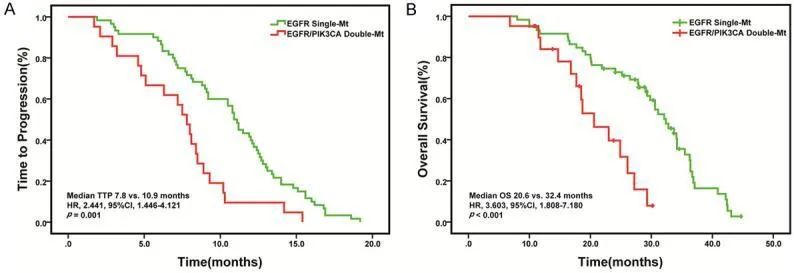
图4[14]:EGFR/PIK3CA共突变患者接受EGFR-TKIs治疗的TTP和OS
基于目前现有的证据,针对EGFR/PIK3CA共突变的NSCLC患者的治疗策略如下:
①靶向联合化疗:EGFR-TKIs与化疗的联用可能会通过不同的途径产生协同作用而导致耐药性的延迟,回顾性研究已证实[16],与单用奥希替尼相比,奥希替尼联合化疗可显著改善EGFR/PIK3CA共突变晚期NSCLC患者的PFS。
②靶向联合PI3K/AKT/mTOR信号通路抑制剂:理论上,EGFR抑制剂阻碍EGFR活性,而PI3K/AKT/mTOR途径抑制剂作用于 PI3K/AKT/mTOR途径,这些途径可能在抑制肿瘤细胞增殖、克服单一靶点所面临的耐药以及延长OS方面进行协作。目前EGFR-TKIs联合 PI3K抑制剂如厄洛替尼+LY294002、厄洛替尼+BKM120、厄洛替尼+Pilaralisib;EGFR-TKIs联合AKT抑制剂如厄洛替尼+MK-2206;EGFR-TKIs联合mTOR抑制剂如EGFR-TKIs+Everolimus;EGFR-TKIs联合PI3K/mTOR双重抑制剂如厄洛替尼+XL765等方面临床研究均尚在探索阶段,期待后续结果。
③靶向联合抗血管生成药物:RELAY研究证实了雷莫芦单抗+厄洛替尼可提升EGFR/PIK3CA共突变患者的PFS,然而EGFR-TKIs联合安罗替尼或阿帕替尼治疗EGFR/PIK3CA共突NSCLC仅为个案病例,病例有限,仍需进一步探索。
三、EGFR与ALK共突变
研究已表明,ALK重排NSCLC总数约为3%~5%,并通过激活下游信号如Ras/MAPK、PI3K/AKT和JAK/STAT通路而介导肺癌的增殖、迁移和转移。早期研究发现,EGFR突变和ALK重排的发生相互排斥,但随着检测技术的提高发现存在EGFR/ALK重排共突变的NSCLC患者,其发生率约为0.45%~1.6%,占EGFR突变的3.9%~13.6%,占ALK重排的 15.4%~18.8%[3],其中,EML4-ALK/EGFR共突变患者发生率低于非EML4-ALK/EGFR共突变患者[17]。
目前EGFR/ALK共突变的分子机制尚未明确研究认为EGFR/ALK共突变的患者肿瘤组织存在高度异质性即两种突变可发生于不同的肿瘤细胞中,也可发生于同一肿瘤细胞内,肿瘤异质性的不同,临床治疗方案选择及临床获益也不同。鉴于现有的证据,针对EGFR/ALK共突变的 NSCLC患者的治疗策略如下:
①单药靶向药物序贯治疗:部分研究表明EGFR-TKIs一线治疗 EGFR/ALK共突变的NSCLC患者优于ALK-TKIs[18-20](图5);另一些研究表明ALK-TKIs一线治疗EGFR/ALK共突变的NSCLC患者优于EGFR-TKIs[21](图6),因此,如何选择一线治疗方案尚缺乏统一的共识。基于肿瘤异质性的存在,可根据检测EGFR和ALK基因突变丰度和EGFR和ALK磷酸化的水平来选择治疗方案,即EGFR低丰度患者优选ALK-TKIs,EGFR高丰度患者优选EGFR-TKIs;EGFR磷酸化水平高于ALK磷酸化患者优选EGFR-TKIs,EGFR磷酸化水平低于ALK磷酸化患者优选ALK-TKIs。两种靶向药物序贯治疗为最优方案,当选择EGFR-TKIs/ALK-TKIs一线治疗耐药后再选择另一种靶向药物[22]。
②双靶向药物同时治疗:理论上,可同时选择使用EGFR-TKIs和ALK-TKIs一线治疗EGFR/ALK共突变的NSCLC患者,但考虑药物不良反应的叠加及药物经济性问题,两种靶向药物同时使用得慎重考虑。
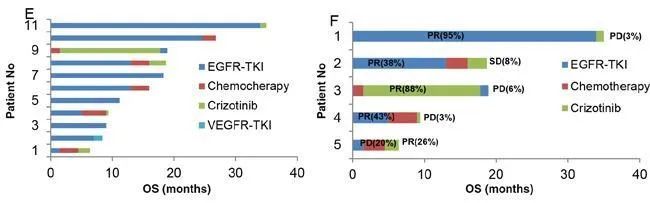
图5[20]:EGFR-TKIs一线治疗EGFR/ALK共突变的NSCLC患者优于ALK-TKIs
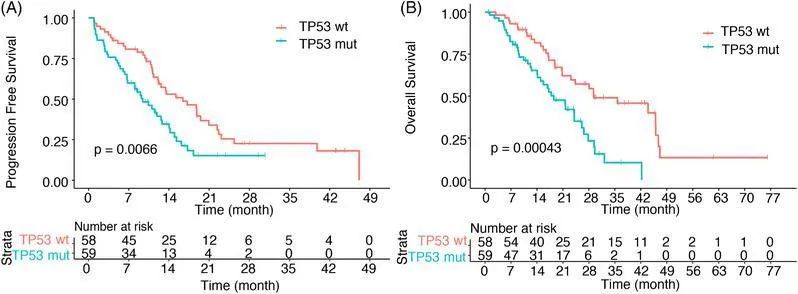
图6[21]:ALK-TKIs一线治疗EGFR/ALK共突变的NSCLC患者优于EGFR-TKIs
四、EGFR与KRAS共突变
KRAS是RAS基因亚型中最常见的致癌基因,当KRAS基因突变时,可持续激活下游的PI3K-AKT-mTOR及Ras-Raf-MEK-ERK信号通路而介导肿瘤细胞的增殖、侵袭和转移,促进肿瘤的发生和发展。KRAS突变存在于32%的肺腺癌和4%的鳞状细胞肺癌中,其最常见的KRAS突变位点是KRASG12C,占全部KRAS突变的40%,其他位点还包括G12D、G12V、G12A、G12R和G12S等[23]。通常认为,KRAS与EGFR突变相互排斥,但目前研究报道发现5.8%~35.8%的NSCLC患者存在 EGFR/KRAS共突变现象[24]。
对于EGFR突变无疑可选择EGFR-TKIs,而KRAS突变的靶向治疗仍然是目前治疗的瓶颈,无论是ASCO、ESMO还是CSCO,KRAS抑制剂的研究依然是KRAS靶点的明星,虽然很多KRAS抑制剂初步研究结果是喜人的,但到临床获批至临床广泛使用还需要进一步临床研究来佐证与支持。针对EGFR/KRAS共突变患者,目前的病例及研究较少,既往研究表明,KRAS突变会降低EGFR-TKIs的敏感性,从而降低治疗的PFS和OS[25],可以预见的是联合治疗才是未来最优策略。
基于目前药物可及性和证据,针对EGFR/KRAS共突变的NSCLC患者的治疗策略如下:
①单药靶向治疗:鉴于药物可及性,可首先选择单药EGFR-TKIs,部分患者仍然可从EGFR-TKIs中获益,若出现进展后再考虑后线治疗如 KRAS抑制剂或免疫检查点抑制剂联合抗血管生成药物+化疗等。
②双靶治疗:若患者KRAS突变靶点为G12C位点,相应抑制剂如 Sotorasib(AM510)及Adagrasib(MRTX849)已取得良好的疗效。目前,使用EGFR-TKIs联合KRAS抑制剂疗效及安全性仍未知,在 2024ASCO年会上,KRASG12C抑制剂fulzerasib(GFH925)联合 EGFR抑制剂西妥昔单抗一线治疗NSCLC的II期临床研究获得了80%的ORR和100%的DCR[26],提示williamhill asia KRAS抑制剂联合EGFR抑制剂治疗EGFR/KRAS共突变的NSCLC患者的可行性。
五、EGFR与MET扩增共突变
MET基因异常可以激活下游信号通路RAS/RAF/MAP和 PI3K/AKT/mTOR而导致肿瘤细胞增殖、迁移和侵袭,MET基因异常主要包括:MET14外显子跳突、MET扩增及MET融合等。MET扩增是指MET基因的拷贝数增加包括多体和局部扩增两种形式,其既可作为原发性驱动基因,也可作为继发性驱动基因,继发性MET扩增已被认为是EGFR-TKIs获得性耐药的常见机制之一。数据显示,原发性MET基因扩增占NSCLC的1%~5%,而EGFR/MET扩增共突变的概率约3%[27]。
研究显示,EGFR/MET扩增共突变会降低EGFR-TKIs治疗的敏感性,MET扩增可通过激活旁路通路而介导EGFR-TKIs产生耐药性,克服这种耐药性的有效策略是EGFR-TKIs联合MET-TKIs。
目前现有证据表明,针对EGFR/MET扩增共突变的NSCLC患者的治疗策略为EGFR-TKIs联合MET-TKIs。一项回顾性研究表明[28],EGFR-TKIs联合克唑替尼治疗EGFR/MET扩增共突NSCLC患者显示出良好的疗效。奥希替尼联合赛沃替尼在治疗EGFR/MET扩增共突NSCLC患者个案报道中也显示出惊人的疗效,FLOWERS研究和SANOVO研究也均在开展,旨在探索奥希替尼联合赛沃替尼用于EGFR合并原发MET扩增NSCLC患者的疗效,期待后续结果。
六、EGFR与PTEN共突变
PTEN属于肿瘤抑制基因,参与编码PTEN蛋白,当蛋白质水平下调,杂合性缺失和表观遗传沉默等导致PTEN蛋白失活并激活PI3K/AKT信号通路而促进肿瘤细胞的增殖。PTEN缺失发生在NSCLC中的概率约占40%以上,EGFR基因与PTEN缺失共突变较少见,尚无数据统计。
已有研究表明,PTEN缺失与临床不良预后相关,同时会降低EGFR-TKIs治疗的敏感性[29]。研究发现,EGFR突变合并PTEN缺失的患者接受 EGFR-TKIs治疗的PFS和OS短于仅发生EGFR突变的患者,同时PTEN缺失和PTEN低蛋白表达是EGFR-TKIs治疗的预后不良独立影响因素[30](图7)。然而,高PTEN表达水平与OS延长有关[31]。
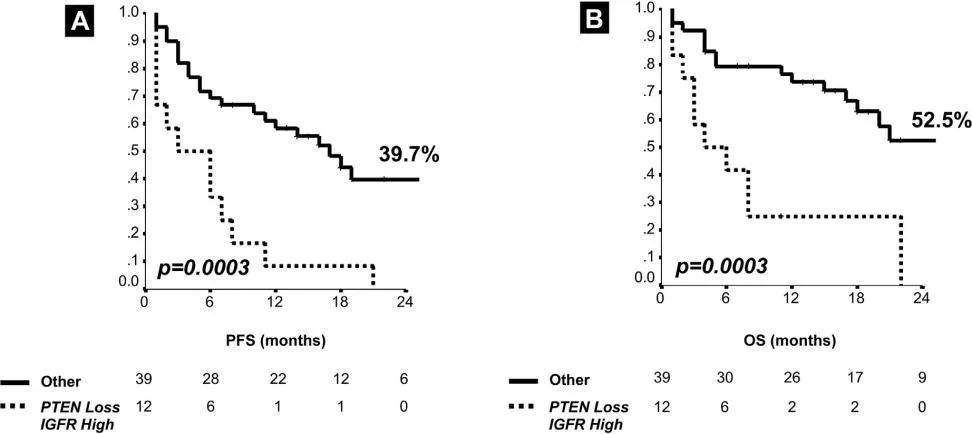
图7[30]:EGFR/PTEN缺失共突变患者接受EGFR-TKIs治疗的PFS和OS
目前由于缺乏个案报道、回顾性分析以及前瞻性临床研究的证据支持,难以对EGFR/PTEN共突变患者做出更好的方案选择,单药选择EGFR-TKIs是目前可及的治疗方案,相信随着研究的深入,临床决策会得到优化。
总结
综上所述,针对EGFR共突变人群进行优化方案探索时,不同的EGFR共突变人群应明白使用单靶治疗、靶向联合化疗、靶向联合抗血管生成药物、双靶序贯治疗以及双靶同时治疗等不同治疗策略,不能局限于只用EGFR-TKIs而缩短了患者的PFS和OS。在此基础上,应进一步探究联合治疗的机制和如何筛选优势人群,不能把不同手段的治疗胡乱叠加,影响疗效的同时增加了副反应,降低患者的临床获益。
参考文献:
[1] Mathiot L, Nigen B, Goronflot T, et al. Prognostic Impact of TP53 Mutations in Metastatic Nonsquamous Non-small-cell Lung Cancer[J]. Clin Lung Cancer, 2024, 25(3): 244-253.e2.
[2] Shang K, Huang H, Xu Y,et al. Efficacy and safety analyses of epidermal growth factor receptor tyrosine kinase inhibitors combined with chemotherapy in the treatment of advanced non-small-cell lung cancer with an EGFR/TP53 co-mutation[J]. BMC Cancer. 2022 Dec 12;22(1):1295.
[3] Guo Y, Song J, Wang Y, et al. Concurrent Genetic Alterations and Other Biomarkers Predict Treatment Efficacy of EGFR-TKIs in EGFR-Mutant Non-Small Cell Lung Cancer: A Review[J]. Front Oncol, 2020,10: 610923.
[4] Gu W, Liu P, Tang J, et al. The prognosis of TP53 and EGFR co-mutation in patients with advanced lung adenocarcinoma and intracranial metastasis treated with EGFR-TKIs[J]. Front Oncol. 2024 Feb 5;13:1288468.
[5] Peng M, Hu Q, Wu Z, et al. Mutation of TP53 Confers Ferroptosis Resistance in Lung Cancer Through the FOXM1/MEF2C Axis[J]. Am J Pathol, 2023, 193(10): 1587-1602.
[6] Canale M, Petracci E, Delmonte A, et al. Impact of TP53 Mutations on Outcome in EGFR-Mutated Patients Treated with First-Line Tyrosine Kinase Inhibitors[J]. Clin Cancer Res. 2017,23(9):2195-2202.
[7] Yang Z, Chen Y, Wang Y, et al. Efficacy of EGFR-TKI Plus Chemotherapy or Monotherapy as First-Line Treatment for Advanced EGFR-Mutant Lung Adenocarcinoma Patients With Co-Mutations. Front Oncol. 2021 Aug 16;11:681429.
[8] Sun H, Ren P, Chen Y, et al. Optimal therapy for concomitant EGFR and TP53 mutated non-small cell lung cancer: a real-world study[J]. BMC Cancer. 2023 Mar 2;23(1):198.
[9] Zhang L ZH, Zhang Z, Yao W, et al. ACTIVE: Apatinib plus gefitinib versus placebo plus gefitinib as first-line treatment for advanced epidermal growth factor receptor-mutant (EGFRm) non-small-cell lung cancer (NSCLC): A multicentered, randomized,double-blind, placebo-controlled phase III trial (CTONG1706)[J]. Ann Oncol (2020) 31(suppl_4):S1142–215.
[10] Nishio M, Paz-Ares L, Reck M, et al. RELAY, Ramucirumab Plus Erlotinib (RAM+ERL) in Untreated Metastatic EGFR-Mutant NSCLC (EGFR+ NSCLC): Association Between TP53 Status and Clinical Outcome[J]. Clin Lung Cancer. 2023 Jul;24(5):415-428.
[11] Zhang L, Wang L, Wang J, et al . Anlotinib plus icotinib as a potential treatment option for EGFR-mutated advanced non-squamous non-small cell lung cancer with concurrent mutations:final analysis of the prospective phase 2, multicenter ALTER-L004 study[J]. Mol Cancer. 2023 Aug 5;22(1):124.
[12] Zhang C, Wang K, Lin J, et al. Non-small-cell lung cancer patients harboring TP53/KRAS co-mutation could benefit from a PD-L1 inhibitor[J]. Future Oncol. 2022 Sep;18(27):3031-3041.
[13] Liu X, Mei W, Zhang P, et al. PIK3CA mutation as an acquired resistance driver to EGFR-TKIs in non-small cell lung cancer: Clinical challenges and opportunities[J]. Pharmacol Res. 2024 Apr;202:107123.
[14] Qiu X, Wang Y, Liu F, et al. Survival and prognosis analyses of concurrent PIK3CA mutations in EGFR mutant non-small cell lung cancer treated with EGFR tyrosine kinase inhibitors[J]. Am J Cancer Res. 2021 Jun 15;11(6):3189-3200.
[15] Eng J, Woo KM, Sima CS, et al. Impact of Concurrent PIK3CA Mutations on Response to EGFR Tyrosine Kinase Inhibition in EGFR-Mutant Lung Cancers and on Prognosis in Oncogene-Driven Lung Adenocarcinomas[J]. J Thorac Oncol. 2015 Dec;10(12):1713-9.
[16] Gu W, Zhang H, Lu Y, et al. EGFR-TKI Combined with Pemetrexed versus EGFR-TKI Monotherapy in Advanced EGFR-mutated NSCLC: A Prospective, Randomized, Exploratory Study[J]. Cancer Res Treat. 2023 Jul;55(3):841-850.
[17] Liu J,Mu Z,Liu L,et al. Frequency,clinical features and differential response to therapy of concurrent ALK/EGFR alterations in Chinese lung cancer patients[J]. Drug Des Devel Ther, 2019, 13: 1809-1817.
[18] Yang JJ, Zhang XC, Su J, et al. Lung cancers with concomitant EGFR mutations and ALK rearrangements: diverse responses to EGFR-TKI and crizotinib in relation to diverse receptors phosphorylation[J]. Clin Cancer Res (2014) 20:1383–92.
[19] Yang X, Zhong J, Yu Z, et al. Genetic and treatment profiles of patients with concurrent Epidermal Growth Factor Receptor (EGFR) and Anaplastic Lymphoma Kinase (ALK) mutations[J]. BMC Cancer. 2021 Oct 15;21(1):1107.
[20] Lou NN, Zhang XC, Chen HJ, et al. Clinical outcomes of advanced non-small-cell lung cancer patients with EGFR mutation, ALK rearrangement and EGFR/ALK co-alterations[J]. Oncotarget (2016) 7:65185–95.
[21] 韩骐蔓.EGFR与ALK共突变在非小细胞肺癌中的探索性研究[D].青岛大学,2022.DOI:10.27262/d.cnki.gqdau.2021.000349.
[22] Zhao Y, Wang S, Zhang B, et al. Clinical management of non-small cell lung cancer with concomitant EGFR mutations and ALK rearrangements: efficacy of EGFR tyrosine kinase inhibitors and Crizotinib[J]. Target Oncol.2019,14(2):169-178.
[23] Singhal A, Li BT, O'Reilly EM. Targeting KRAS in cancer[J]. Nat Med. 2024 Apr;30(4):969-983.
[24] Ulivi P, Chiadini E, Dazzi C, et al. Nonsquamous, Non-Small-Cell Lung Cancer Patients Who Carry a Double Mutation of EGFR, EML4-ALK or KRAS: Frequency, Clinical-Pathological Characteristics, and Response to Therapy[J]. Clin Lung Cancer (2016) 17:384–90.
[25] Guibert N, Barlesi F, Descourt R, et al. Characteristics and Outcomes of Patients with Lung Cancer Harboring Multiple Molecular Alterations: Results from the IFCT Study Biomarkers France[J]. J Thorac Oncol. 2017,12(6):963-973.
[26] Gregorc, Vanesa, et al. KROCUS: A phase II study investigating the effic-acy and safety of fulzerasib (GFH925) in combination with cetuximab in patien-ts with previously unt reated advanced KRAS G12C mutated NSCLC. (2024): LB-A8511-LBA8511.
[27] Schildhaus H.U, Schultheis A.M, Ruschoff J, et al. MET amplification status in therapy-naive adeno- and squamous cell carcinomas of the lung[J]. Clin Cancer Res. 2015;21(4):907–915.
[28] Mi J, Huang Z, Zhang R, et al. Molecular characterization and clinical outcomes in EGFR-mutant de novo MET-overexpressed advanced non-small-cell lung cancer[J]. ESMO Open. 2022,7(1):100347.
[29] Wang F, Diao XY, Zhang X, et al. Identification of genetic alterations associated with primary resistance to EGFR-TKIs in advanced non-small-cell lung cancer patients with EGFR sensitive mutations[J]. Cancer Commun (Lond) (2019) 39:7.
[30] Ferrara MG, Martini M, D'Argento E, et al. PTEN Loss as a Predictor of Tumor Heterogeneity and Poor Prognosis in Patients With EGFR-mutant Advanced Non-small-cell Lung Cancer Receiving Tyrosine Kinase Inhibitors[J]. Clin Lung Cancer. 2021 Jul;22(4):351-360.
[31] Endoh H, Yatabe Y, Kosaka T, et al. PTEN and PIK3CA expression is associated with prolonged survival after gefitinib treatment in EGFR-mutated lung cancer patients[J]. J Thorac Oncol (2006) 1:629-34.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#NSCLC# #EGFR-TKIs# #EGFR基因共突变#
1