Cancer Discov:脑瘤调控癌细胞和神经元之间“对话”的新机制
2024-06-20 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
该研究揭示了表观调控因子CHD2可以在以H3.1K27M突变为特征的DMG中调节表观遗传标记,从而调控大量轴突导向基因和突触相关基因的表达,从而在DMG肿瘤细胞与神经元的相互作用中发挥关键作用。
弥散性中线胶质瘤( DMG)是一种高度恶性和侵袭性的脑肿瘤,主要发生在儿童和年轻人中。DMG病灶位于大脑的中线结构,如脑干、丘脑和脊髓。由于具有高度侵袭性,病情发展迅速,且尚无有效的靶向治疗药物,DMG预后极差,确诊后的平均存活时间不到一年。大多数DMG病例中,肿瘤细胞携带一种名为H3K27M的突变,该突变会引起癌细胞表观遗传组的剧烈变化,进一步影响基因表达模式,促进肿瘤生长和恶化。
癌症神经科学是一门研究癌细胞与神经系统相互作用的学科。简单来说,它探索的是癌细胞如何与神经系统沟通,并利用这种沟通促进自身的生长和扩散。试想,当“入侵者”——肿瘤与作为“情报站”的神经系统秘密“对话”,使其帮助自己攻城略地,是不是很危险?目前,研究人员已经发现多种癌细胞可以通过多种方式与神经元互动,特别是在高级别胶质瘤( HGG),包括弥散性中线胶质瘤(DMG)、成人和儿童的胶质母细胞瘤及间变性少突胶质细胞瘤等。例如DMG癌细胞能够与神经元直接形成功能性突触。这种神经元-癌细胞突触能够传递来自神经元的信号,促进DMG癌细胞的增殖、侵袭和扩散。然而,尚不清楚肿瘤细胞的基因表达是如何被调控,从而使其能与神经系统建立联系。
近日,来自哥伦比亚大学的 张志国 教授团队在 Cancer Discovery 发表了题为CHD2 Regulates Neuron-glioma Interactions in Pediatric Glioma的研究论文,揭示了表观调控因子CHD2可以在以H3.1K27M突变为特征的DMG中调节表观遗传标记,从而调控大量轴突导向基因和突触相关基因的表达,从而在DMG肿瘤细胞与神经元的相互作用中发挥关键作用。

为分析H3.1K27M突变的DMG肿瘤细胞具有独特基因表达模式的原因,研究团队利用7种来源于患者的胶质瘤细胞模型进行CRISPR大规模筛选,发现CHD2是特异性调节H3.1K27M 突变的DMG肿瘤细胞生长的关键基因。因此,他们随后的研究聚焦于CHD2这个 CHD家族染色质重构体因子。
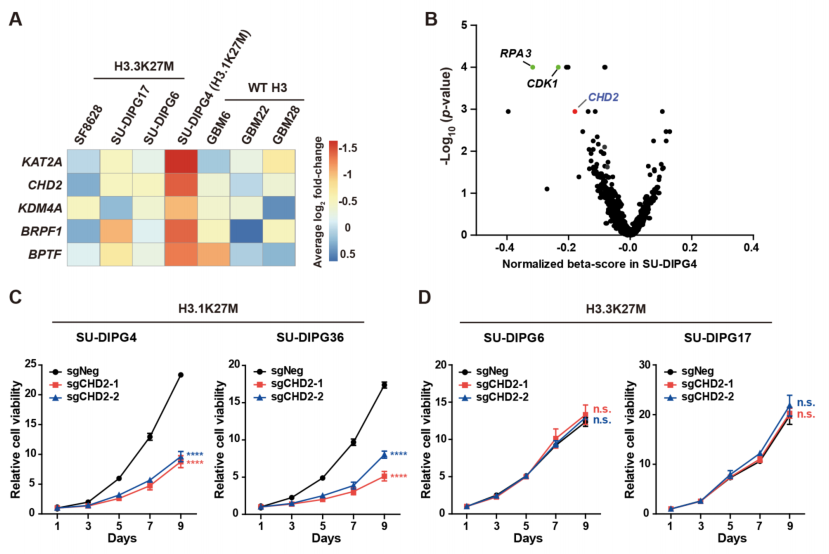
通过CRISPR筛选鉴定并验证CHD2特异性调节H3.1K27M 突变DMG肿瘤细胞生长
通过对CHD2表达水平以及对公共肿瘤单细胞测序数据的分析,研究人员进一步确定了CHD2对于H3.3K27M DMG细胞的特异性。相比较于H3.3K27M DMG细胞,CHD2在H3.1K27M DMG细胞中特异性高表达。使用异种移植体系,将CHD2敲除的肿瘤细胞注射小鼠脑干部,发现只有在H3.1K27M DMG中敲除CHD2可以显著延长荷瘤小鼠的生存时间。
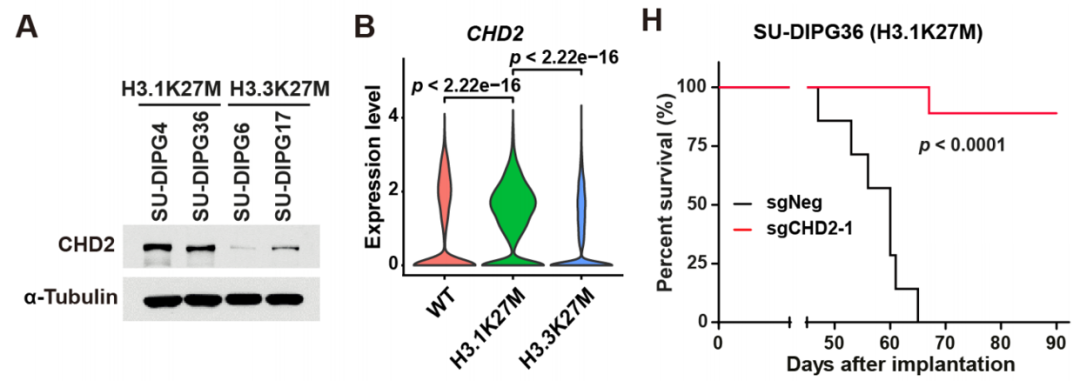
CHD2在H3.1K27M肿瘤中特异性高表达并对移植瘤致病性是必须的
为探索CHD2如何调控H3.1K27M的DMG肿瘤细胞基因表达,研究人员通过RNA-seq和CUT&RUN实验发现,CHD2直接结合并调节大量轴突导向基因和突触相关基因的表达,这提示CHD2可能参与调节肿瘤与神经元之间的相互作用。
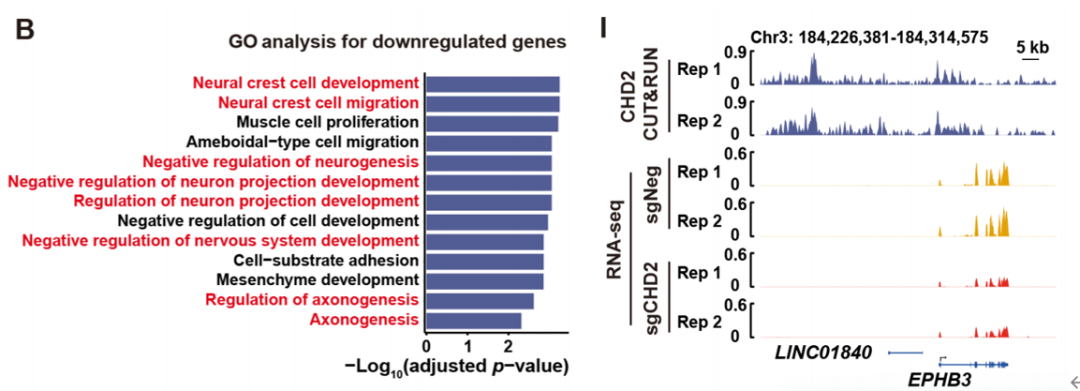
CHD2在H3.1K27M DMG细胞中结合并调节轴突导向和突触基因表达
为验证这一推测,研究人员首先建立了癌细胞-神经元共培养体系,证实了在H3.1K27M DMG肿瘤细胞中敲除CHD2显著降低神经元对肿瘤细胞增殖的促进作用;而在肿瘤细胞单独培养时,CHD2敲除完全没有影响。同时,敲除CHD2后的H3.1K27M肿瘤细胞与神经元建立突触连接的数量大大减少。类似的,在共培养体系中敲除H3.1K27M DMG肿瘤细胞中的CHD2会显著降低肿瘤细胞中的钙瞬变信号强度和频率。这些结果表明,CHD2 主要是通过调控肿瘤细胞-神经元之间突触的形成来影响H3.1K27M DMG肿瘤细胞接收来自神经元信号。
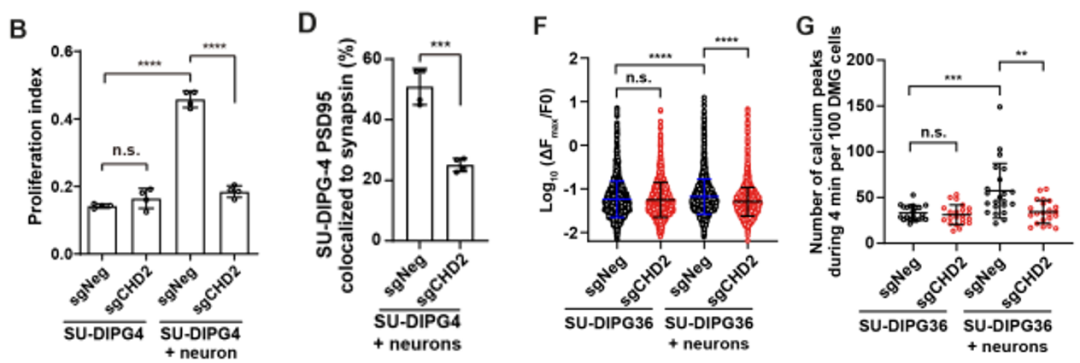
CHD2敲除显著抑制H3.1K27M DMG与神经细胞共培养时的增殖及信号传递
为了进一步在体内证实上述发现,作者团队在小鼠海马CA1区异种移植表达GCaMP6s的H3.1K27M DMG细胞,接种定殖一段时间后,分别于原位进行钙离子成像并对脑片进行肿瘤增殖能力的分析。他们发现,CHD2的敲除显著降低异种移植H3.1K27M DMG的增殖,并且显著降低接种肿瘤位置自发钙瞬变的水平。类似的,当电刺激CA3区域时,CA1区域的肿瘤细胞中原本应被激活的钙信号在CHD2敲除后的也显著降低。这些体内实验进一步证实,在H3.1K27M DMG肿瘤细胞中,CHD2对调节肿瘤细胞和神经元的相互作用发挥着关键作用。
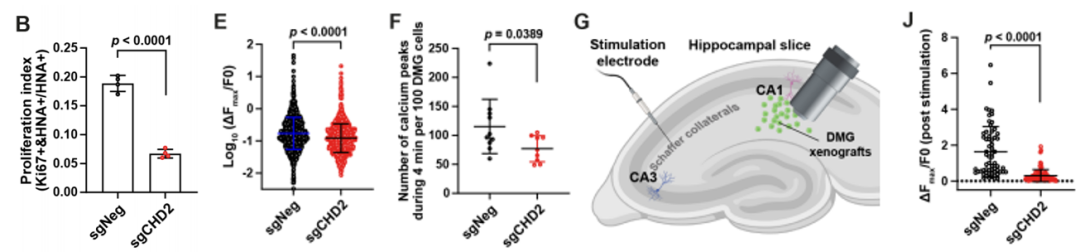
CHD2敲除在体内显著抑制H3.1K27M DMG与神经细胞之间的互作
为了确定CHD2如何被招募到H3.1K27M DMG肿瘤细胞中的特定染色质区域,研究人员对于H3.1K27M DMG细胞中发现的9,701个CHD2 CUT&RUN峰进行了从头分析,他们发现,H3.1K27M DMG肿瘤细胞基因组上CHD2的结合区域,富含转录因子FOSL1的结合位点。通过免疫共沉淀实验和CUT&RUN实验证实,CHD2和FOSL1共同结合在基因组上大部分位置,尤其是大量轴突导向基因和突触相关基因位点。在H3.1K27M DMG肿瘤细胞中敲除CHD2或者FOSL1,都会降低大量轴突导向基因和突触相关基因的表达水平。这证明了CHD2-FOSL1轴对H3.1K27M DMG细胞与神经元互作过程有调控作用。
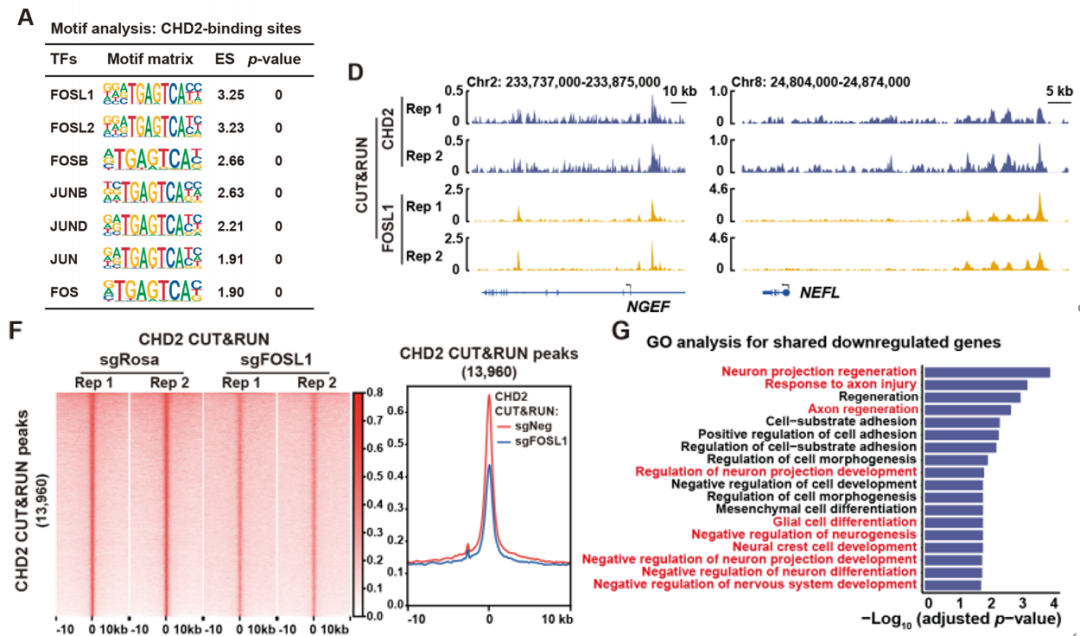
CHD2与FOSL1在染色质上共定位,调节轴突导向和突触基因表达
那么,CHD2-FOSL1是如何通过表观遗传调控H3.1K27M DMG肿瘤细胞基因表达的呢?在H3.1K27M DMG肿瘤细胞中对表观遗传修饰进行CUT&RUN发现,CHD2敲除或FOSL1敲除提高全局性H3K27me3的水平,并且降低大量位点的H3K4me3和H3K27ac水平,并且这些位点附近的基因富集在轴突导向、神经元投射及突触传递相关的通路。这进一步阐释了CHD2-FOSL1调控与肿瘤-神经元互作相关基因表达的机制。
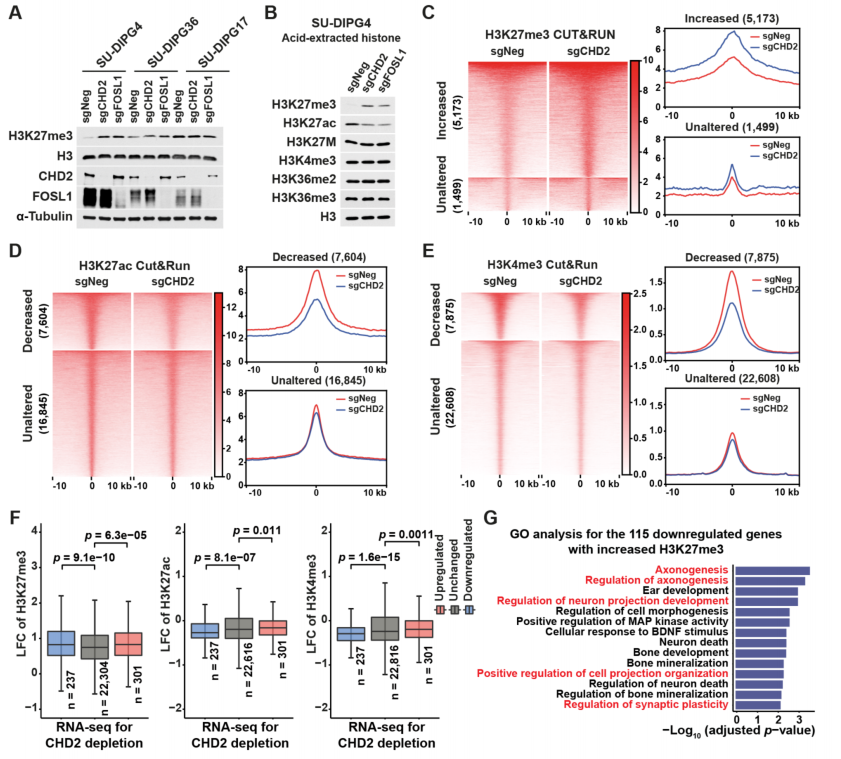
CHD2和FOSL1调节H3.1K27M DMG细胞的组蛋白修饰,调控肿瘤-神经元互作相关基因表达
理解肿瘤细胞如何与神经系统“交流”,不仅具有重要的理论意义,而且有助于发掘新的治疗靶点。值得注意的是,不同的胶质瘤亚型可能采用不同的机制来维持其与周围神经元的互作,因此,需要理解不同亚型中基因表达调控机制的特异性以提高治疗策略的精准性。
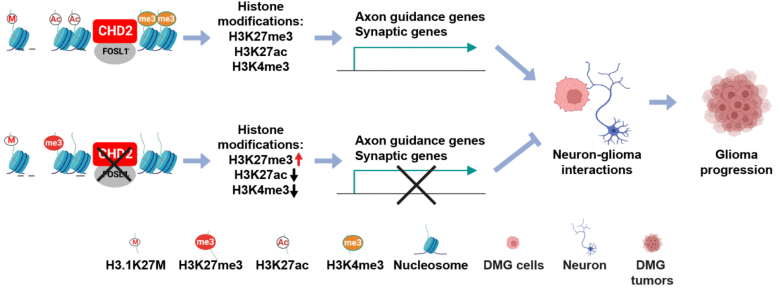
CHD2和FOSL1调节H3.1K27M DMG肿瘤细胞的组蛋白修饰,进而调控靶基因的表达,影响神经元与胶质瘤的互作以及癌症进程
该研究首次揭示了染色质重塑因子CHD2在H3.1K27M突变的弥散性中线胶质瘤中,通过调控肿瘤细胞中轴突导向与突触相关基因的表达,从而控制胶质瘤细胞与神经元的相互作用的机制。由于CHD2在H3.1K27M DMG肿瘤中特异性高表达,未来有望通过靶向CHD2为这种胶质瘤亚型提供精准的治疗。这不仅为揭示胶质瘤-神经元相互作用的复杂机制提供了新视角,也为开发新疗法指明了方向。
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















#基因表达# #弥散性中线胶质瘤# #CHD2#
59