Nature:胰腺癌原来是这样“找饭吃”的!
2019-03-28 Michael 转化医学网
肿瘤细胞在增殖、生长及转移过程中需要大量的能量供应。这一巨大的能量需求单单通过循环系统来输送远远不够,它需要借助巨噬细胞破坏其他正常细胞才能满足其自身的能量供应。
导语
肿瘤细胞在增殖、生长及转移过程中需要大量的能量供应。这一巨大的能量需求单单通过循环系统来输送远远不够,它需要借助巨噬细胞破坏其他正常细胞才能满足其自身的能量供应。
来自德州大学的Giulio Draetta教授及其同事发现胰腺癌细胞表面的一种名为syndecan-1(SDC1)的蛋白质可以响应胞内KRAS的信号,并促进巨噬细胞的破坏作用。这项研究发表于最新的《Nature》杂志。
“癌症之王”胰腺癌本身就令人不寒而栗,而90%胰腺导管癌中存在KRAS突变。KRAS突变会通过尚不明确的机制激活肿瘤微环境的巨噬细胞,并促进巨噬细胞的胞吞作用。但这其中的机制一直困扰着研究人员,找到这些内在的机制或许可以帮助研究人员发现治疗胰腺癌的新靶点。
细胞膜能够响应来自细胞和外部环境的信号进而产生相应的动态变化。在癌细胞中,基因突变为细胞提供了准确的变化指示,进而诱导细胞进入不受控制的“疯狂增殖”状态。
Draetta的团队认为,详细了解KRAS突变如何重新“规划”细胞膜功能,将揭示胰腺癌细胞增殖生存通路的关键机制。Draetta教授表示,“在细胞表面存在多种致癌机制,其中KRAS与细胞膜能够相互作用,直接指导细胞的恶性转化和维持肿瘤的生存。
先前对细胞表面复杂机制的认识一直受到技术的限制,直到现在胰腺癌细胞中KRAS信号传导与细胞表面的功能和组成关系一直未被阐明”。
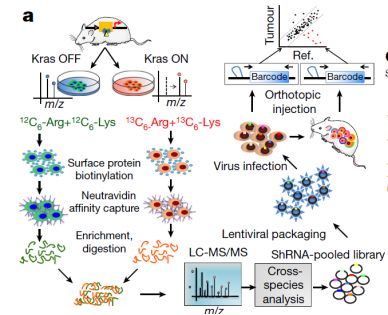
由于KRAS的突变率在胰腺导管腺癌中十分高,这导致患者的五年内生存率只有8%。为了研究KRAS与细胞膜的联系,研究人员设计了一种研究胰腺癌中KRAS分别处于开放和关闭状态下,细胞表面变化情况的模型。
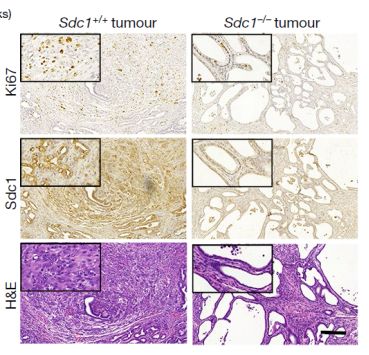
研究人员发现,细胞表面的蛋白质对KRAS的表达产生了巨大的响应变化,而SDC1是在KRAS通路开放时变化最为活跃的。这提示KRAS可指导SDC1整合到细胞膜表面并发挥其功能。研究人员使用不同的方法来阻止SDC1整合到细胞膜中,其结果发现只有当SDC1表达于细胞表面才能激活巨噬细胞。
尽管对KRAS在维持胰腺癌细胞存活方面的研究有了很大的进展,但研究人员尚难以开发出针对KRAS的靶向治疗方法,这导致目前临床上没有可以关闭KRAS信号通路,进而杀死癌细胞的药物。在了解到SDC1在KRAS的控制下为胰腺癌细胞提供能量后,研究人员有望利用这一通路开发出靶向SDC1的治疗方案。
Draetta 教授表示,细胞表面是一个令人兴奋的地方,在那儿可以找到更多癌细胞与正常细胞本质上的区别。
目前,针对SDC1的单克隆抗体正在在多发性骨髓瘤中进行测试,这一药物可能会开启胰腺癌类似疗法的临床研究”。了解胰腺癌细胞是如何“找饭吃”,再利用这一机制切断其能量供应,这可能是未来治疗胰腺癌的关键方案。
原始出处:Wantong Yao, Johnathon L. Rose, et al. Syndecan 1 is a critical mediator of macropinocytosis in pancreatic cancer. Nature. 27 March 2019
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言








#Nat#
54