Cell Stem Cell:利用改进的CRISPR/Cas9技术直接进行细胞转分化
2016-08-13 佚名 生物谷
一项新的研究中,研究人员利用经过基因修饰的CRISPR/Cas9---一种新的革命性的基因编辑技术---将从小鼠结缔组织中分离出的成纤维细胞直接转化为神经元。 2006年,日本京都大学前沿医学科学研究所山中伸弥教授发现如何让来自成年结缔组织的成纤维细胞返回到未成熟的能够分化为任何一种细胞类型的干细胞。这些所谓的诱导性多能干细胞(iPS细胞)因在研究和医学中的巨大潜力仅在6年后
2006年,日本京都大学前沿医学科学研究所山中伸弥教授发现如何让来自成年结缔组织的成纤维细胞返回到未成熟的能够分化为任何一种细胞类型的干细胞。这些所谓的诱导性多能干细胞(iPS细胞)因在研究和医学中的巨大潜力仅在6年后就让山中伸弥教授获得诺贝尔奖。
从那之后,科学家们已发现其他的方法将一种类型的细胞转化为其他类型的细胞。这主要是通过导入多种额外拷贝的“主开关”基因---表达激活特定细胞类型所需的整个基因网路的蛋白---来实现的。
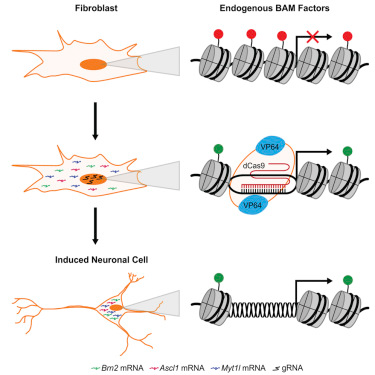
如今,在这项新的研究中,来自美国杜克大学的研究人员开发出一种不再需要导入额外基因拷贝的策略。相反,他们利用一种经过基因修饰的CRISPR/Cas9基因编程技术直接激活已经存在于细胞基因组中的自然拷贝。相关研究结果于2016年8月11日在线发表在Cell Stem Cell期刊上,论文标题为“Targeted Epigenetic Remodeling of Endogenous Loci by CRISPR/Cas9-Based Transcriptional Activators Directly Converts Fibroblasts to Neuronal Cells”。
这些早期的研究结果表明相比于永久性地将新的基因加入到宿主细胞基因组中的方法,利用这种经过基因修饰的CRISPR/Cas9方法实现小鼠胚胎成纤维细胞直接变成神经元的转化过程更加完全和更加持久。
这些神经元细胞可能能够被用来构建神经疾病模型、发现新的治疗方法和开发个人化疗法,而且可能在未来开展细胞疗法。
论文通信作者、杜克大学生物分子与组织工程中心主任和生物医学工程副教授Charles Gersbach博士说,“这种技术在科学研究和医学上具有很多应用。比如,williamhill asia 可能对大多数人的神经元如何对药物作出反应产生一种粗略的印象。获取你大脑的活组织样品来测试你的神经元在伦理上是不允许的。但是如果williamhill asia 能够从你的手臂获得皮肤细胞,将它转化为神经元,然后利用多种药物组合对它进行处理,williamhill asia 就可能确定出一种最佳的个人化疗法。”
论文第一作者、Gersbach实验室研究生Joshua Black说,“面临的挑战就是高效地产生稳定的神经元,而且它们看起来非常类似于你体内真正的神经元。这一直是这个领域的重大障碍。”
二十世纪五十年代,英国发育生物学家Conrad Waddington教授提出未成熟的干细胞分化为特定类型的成体细胞就好像是从一座有脊的山峰沿着侧边滚到众多山谷中的一种。当一种细胞沿着一种特定的斜坡选择每种路径后,它对终极目的地的选择会变得越来越少。
你想要改变这种目的地,一种方法就是将这种细胞垂直地推回到山顶上---这就是将细胞重编程为iPS细胞的想法。另一种选择就是水平地让这种细胞向上翻越一个小山峰,直接进入另一种山谷。
Gersbach说,“如果你能够特特异性地激活所有的神经元基因,那么就可能不一定需要向上翻越这个小山峰。”
之前的方法是通过导入携带额外基因拷贝---能够在细胞内产生大量被称作主转录因子的蛋白---的病毒来做到这一点的。这些蛋白(依据不同的细胞类型,存在不同)结合到基因组上的上千个位点,激活靶细胞的特定基因网络。然而,这种方法也存在一些缺点。
Black说,“不是通过病毒永久性地导入现存基因的额外拷贝而是通过提供一种暂时的信号以一种稳步的方式改变细胞类型将是可取的。然而,高效地做到这一点可能需要对细胞的基因程序作出非常特异性的改变。”
在这项新的研究中,Black、Gersbach和同事们利用经过基因修饰的CRISPR/Cas9技术准确地激活三种基因Brn2、Ascl1和Myt1l来自然地产生这些控制神经元基因网络的主转录因子,而不是导入携带这些额外基因拷贝的病毒。
研究人员先将细菌防御系统CRISPR/Cas9进行基因修饰让它与一种基因激活物偶联在一起,这样仍然能够鉴定出特异性的DNA片段,但是不会切割靶片段,而是让它们保持完整,同时利用基因激活物将靶片段激活。
在实验室中,将这种经过基因修饰的CRISPR/Cas9系统注射到小鼠胚胎成纤维细胞中。检测结果表明一旦被这种系统激活,这三种神经元主转录因子基因就强力地激活神经元基因。这导致这些成纤维细胞传导电信号---神经元的一种典型特征。而且即便将与CRISPR/Cas9偶联的基因激活物取走后,这些细胞仍然保持它们的神经元性质。
Gersbach说,“当将携带表达这三种主转录因子的基因的病毒导入细胞中时,也可能让这些细胞表现得像神经元一样。但是如果它们真地变成自主发挥功能的神经元,那么它们就应当不需要这种外部的刺激持续存在。”
这些实验证实利用这种经过基因修饰的CRISPR/Cas9技术产生的神经元在靶基因上的表观遗传程序与在小鼠大脑组织中自然发现的神经元标志相匹配。
Black解释道,“利用病毒引入额外基因拷贝的方法大量地产生这些转录因子,但是这些基因的自然拷贝非常少地产生这些蛋白。相比之下,这种经过基因修饰的CRISPR/Cas9方法总体上并不产生如此多的转录因子,但是它们是由正常的染色质位点产生的,这就是这些基因在稳步激活后发生的显著差别。williamhill asia 启动这种表观遗传开关来改变细胞类型,而不是通过合成方式迫使它们这样做。”
根据Black的说法,接下来的行动方案就是将这种方法拓展到人类细胞中,提高这种技术的效率,并且试图清除其他的表观遗传障碍,这样它可能能够用来构建特定疾病模型。
Gersbach说,“在未来,你能够想象在体外制造神经元并将它们移植到大脑中来治疗帕金森病或其他神经退行性疾病。但是即便williamhill asia 不能够走到这一步,williamhill asia 仍然能够在实验室中利用这种方法大展手脚来协助开发更好的疗法。”
Joshua B. Black, Andrew F. Adler1, 9, Hong-Gang Wang6, 8, 10, Anthony M. D’Ippolito2, 3, Hunter A. Hutchinson1, Timothy E. Reddy2, 4, Geoffrey S. Pitt6, 7, 8, Kam W. Leong1, 11, Charles A. Gersbach.Targeted Epigenetic Remodeling of Endogenous Loci by CRISPR/Cas9-Based Transcriptional Activators Directly Converts Fibroblasts to Neuronal Cells. Cell Stem Cell DOI: http://dx.doi.org/10.1016/j.stem.2016.07.001
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言










#转分化#
75
#细胞转分化#
63
#RISPR/Cas9#
78
#Cell#
52
#CRISPR/Cas9技术#
64
#CEL#
46
#stem cell#
53
#STEM#
80
#Cas#
82
#Cas9#
0