迄今最大研究:NRAS突变非小细胞肺癌患者的临床和分子特征,对全身治疗的反应
2024-03-15 苏州绘真医学 苏州绘真医学 发表于上海
在本研究中,研究者的目的是确定NRAS突变NSCLC患者的临床和分子特征,并分析这些患者对抗肿瘤全身治疗的反应。
NRAS突变可发生在1%的非小细胞肺癌(NSCLC)中。关于这一罕见肺癌亚群的临床数据很少,而且对化疗或免疫检查点抑制剂(ICI)等全身治疗的反应从未有过报道。本研究纳入了2014年8月至2020年11月在法国14个研究中心连续确诊的NRAS突变NSCLC患者。研究者收集了患者的临床和分子数据,并通过病历进行了审核。在纳入的164例患者中,106例(64.6%)为男性,150例(91.5%)为当前或既往吸烟者,104例(63.4%)在诊断时为IV期NSCLC。中位年龄为62岁,最常见的组织学类型为腺癌(81.7%)。NRAS激活突变主要发生在第61号密码子(70%),第12号密码子和13号密码子突变分别占16.5%和4.9%。PD-L1表达水平<1%/1-49%/≥50%的肿瘤分别占30.8%/27.1%/42.1%。中位随访12.5个月,IV期患者的中位总生存期(OS)为15.3个月(95%CI 9.9~27.6)。不同突变类型(密码子61 vs.其他)的OS差异无统计学意义,HR=1.12(95%CI 0.65~1.95)。在接受含铂双药方案(n=66)、ICI(n=48)或两者联合(n=10)治疗的IV期患者中,客观缓解率和中位无进展生存期分别为45%和5.8个月、35%和6.9个月、70%和8.6个月。NRAS突变NSCLC的特征是高频的吸烟史和第61号密码子突变。免疫联合化疗的疗效需要进一步的研究证实。
-
NRAS突变NSCLC多见于有吸烟史的男性;
-
NRAS突变NSCLC的特征是第61号密码子突变频率高;
-
免疫联合化疗的疗效有待进一步研究;
-
在开发靶向治疗时,应考虑NRAS 第61号密码子突变。
研究背景
在过去的几十年里,癌症生物学的进步使得发现驱动NSCLC肿瘤学过程的分子变异。这些进展促使研究者开发出了靶向疗法,彻底改变了携带可作为治疗靶点的突变(EGFR、MET外显子14、KRAS G12C或BRAF V600E)或重排(ALK、ROS1、RET)的转移性NSCLC患者的治疗和结局。近年来,随着靶向PD-1/PD-L1通路的ICI的出现,免疫治疗也深刻改变了转移性NSCLC的治疗策略。有趣的是,在不同的致癌驱动基因类型的NSCLC中,ICI疗效存在差异,在ALK重排或EGFR突变的患者中,ICI疗效显著降低。
NRAS与KRAS和HRAS一样属于RAS-GTPase家族。约19%的癌症患者携带KRAS、NRAS或HRAS激活突变。KRAS突变在NSCLC中较为常见,而NRAS突变则多见于黑色素瘤、骨髓瘤、慢性髓系白血病、急性髓系白血病和甲状腺癌。这些变异破坏了RAS蛋白的鸟嘌呤交换循环,有利于形成活性的GTP结合状态,从而激活了参与增殖和细胞存活的下游信号通路,如MAPK或PIK3/AKT/mTOR通路。
只有0.6%~1%的NSCLC患者携带NRAS激活突变,这些患者的临床数据很少,在之前发表的队列中仅描述了30例。NRAS突变的NSCLC对化疗或免疫治疗等全身治疗的反应尚不清楚。在本研究中,研究者的目的是确定NRAS突变NSCLC患者的临床和分子特征,并分析这些患者对抗肿瘤全身治疗的反应。
研究结果
临床病理特征:
2014年8月至2020年11月期间,在14个中心共鉴定了173例连续诊断为NRAS突变的NSCLC患者。研究者排除了9例NRAS突变被归类为意义不明变异的患者,164例患者被纳入研究。大多数患者为男性(64.6%)、目前或既往吸烟者(91.5%)(表1)。中位年龄为62岁(范围:35-92)。在诊断时,大多数患者的PS为0或1(75%),IV期NSCLC(63.4%)。最常见的病理类型为腺癌(81.7%)。81.1%的患者可获得PD-L1 TPS,其中30.8%、27.1%和42.1%的患者分别为PD-L1表达低(<1%)、中(1-49%)和高(≥50%)。
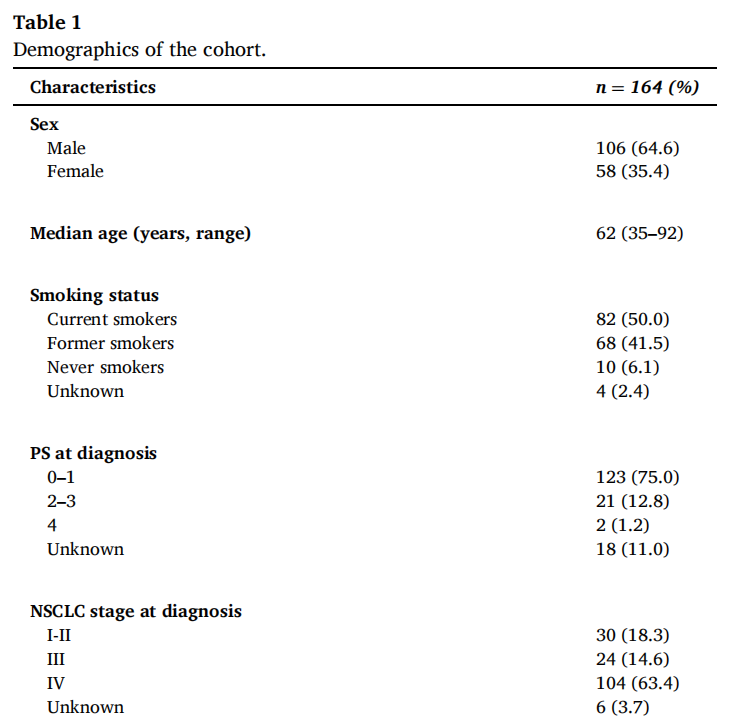

表1
分子特征:
在接受任何抗癌治疗前,161例(98.2%)患者在NSCLC诊断时采集的样本中检测出NRAS突变。在3例携带EGFR突变或ALK重排的患者中,在抗癌治疗开始后的再次活检中检测到NRAS突变。本研究纳入的大多数患者(69.5%)的NRAS突变位于第61号密码子,而仅16.5%和4.9%的患者分别发生了第12号和13号密码子突变(图1)。最常见的NRAS突变亚型是NRAS Q61L(32.9%),其次是Q61R(18.3%)和Q61K(14.6%)。NRAS第12号和13号密码子变异主要表现为NRAS G12D、G12C、G12A和G13R突变。值得注意的是,在15例患者(9.1%)中观察到密码子61、13和12以外的突变。109例患者报告了共发生的分子变异,TP53突变是最常见的。在参与MAPK通路(KRAS、HRAS、BRAF、MAP2K1、MAP2K2)或PI3K通路(PTEN、PIK3CA)、酪氨酸激酶受体编码基因(MET、EGFR、ALK、PDGFRA、FGFR2)或肿瘤抑制基因(STK11、CDKN2A、SMAD4)的基因中发现了其他共变异。
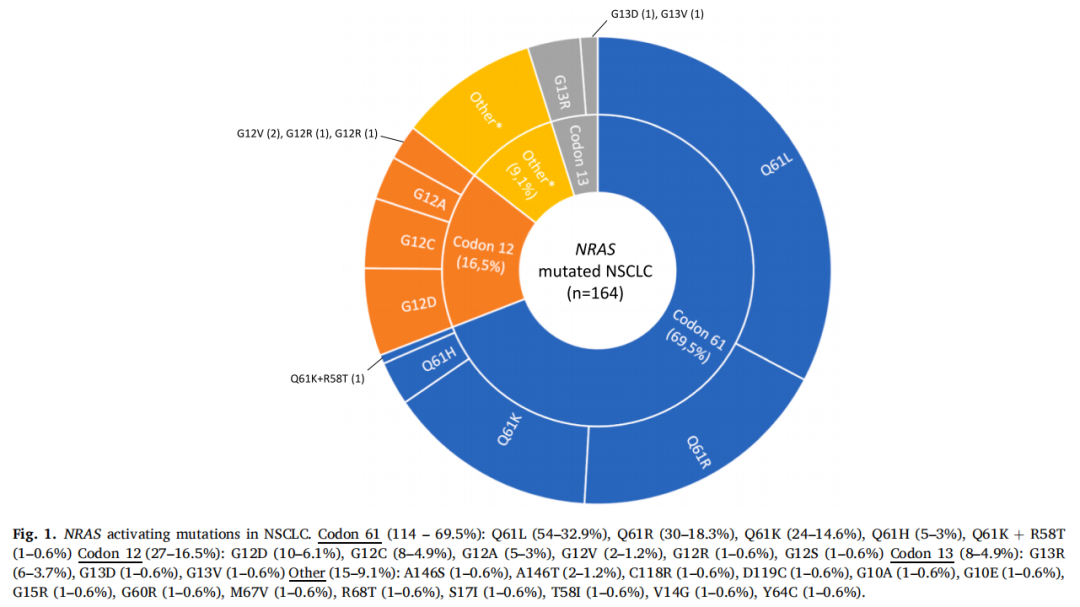
图1
总生存期和预后:
在生存和疗效分析中,仅纳入无EGFR突变和ALK重排且有随访数据的IV期NSCLC患者。从诊断为IV期NRAS突变NSCLC的日期算起,中位随访时间为12.5个月(IQR 5.8-23.6),中位总生存期为15.3个月(95%CI 9.9-27.6)(图2)。根据不同突变类型(第61号密码子vs.其他,HR=1.12;95%CI 0.65-1.95)、PD-L1状态(PD-L1≥50% vs. PD-L1<1%,HR=1.06,95%CI 0.54-2.07;PD-L1 1%-49% vs. PD-L1<1%,HR=1.76,95%CI 0.84-3.66)或吸烟状况(曾经或现在吸烟者vs.从不吸烟者,HR=0.71,95%CI 0.28-1.77),患者的OS差异无统计学意义。
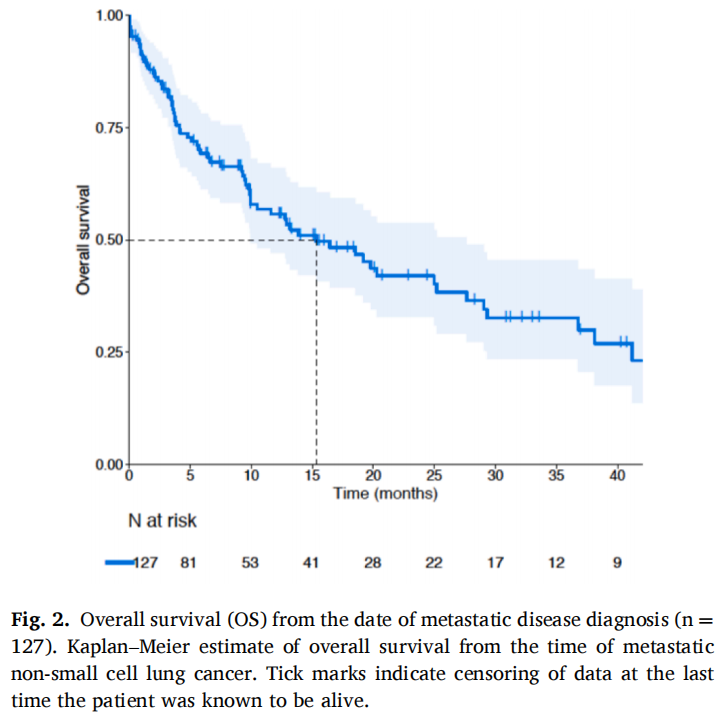
图2
转移性NRAS突变NSCLC的全身治疗活性:
在无ALK重排或EGFR突变的转移性NRAS突变NSCLC患者中,66例患者接受了铂类双药化疗(中位随访时间为14.9个月,IQR 8.1-33.7),48例患者接受了ICI(中位随访时间为15.5个月,IQR 9.3-23.4),10例患者接受了铂类双药化疗联合ICI(中位随访时间为6.1个月,IQR 4.6-8.4)(表2)。铂类双药化疗、ICI、铂类双药化疗联合ICI治疗患者的客观缓解率(ORR)和疾病控制率(DCR)分别为45%和59%、35%和54%、70%和90%。铂类双药化疗、ICI、铂类双药化疗联合ICI治疗患者的中位PFS分别为5.8个月(95%CI 4.5-7.1)、6.9个月(95%CI 4-27.6)、8.6个月(95%CI 8.6-NR)。接受ICI治疗的PD-L1表达低(<1%)、中(1-49%)和高(≥50%)患者的ORR分别为17%、29%和41%(表3)。在一线或二线接受过ICI治疗的患者的ORR分别为36.4%和39.1%。在三线接受ICI治疗的3例患者中,未报告客观缓解(表3)。PD-L1表达≥50%的20例患者接受了帕博利珠单抗作为一线治疗。帕博利珠单抗治疗这些患者的中位PFS和中位OS分别为7.2个月(95%CI 5.6-NR)和25.2个月(95%CI 11.3-NR)。根据PD-L1状态(PD-L1≥50% vs. PD-L1<1%,HR=0.72,95%CI 0.24–2.18;PD-L1 1–49% vs. PD-L1<1%,HR=1.52,95%CI 0.39–5.8)、治疗线(二线vs.一线,HR=1.06,95%CI 0.51-2.21)、NRAS突变类型(密码子61 vs.其他,HR=1.13,95%CI 0.46-2.78)或吸烟状态(既往或现在吸烟者vs.从不吸烟者,HR=0.58;95%CI 0.20-1.72),患者接受ICI治疗的PFS无显著差异。根据不同NRAS突变类型(密码子61 vs.其他,HR=0.78,95%CI 0.44-1.39)、或吸烟状态(既往或现在吸烟者vs.从不吸烟者,HR=0.78,95%CI 0.28-2.18),患者接受铂类双药化疗的PFS也无显著差异。最后,在接受ICI治疗且NGS检测覆盖TP53的33例患者中,不同TP53突变状态的患者接受ICI治疗的PFS无显著差异(有TP53突变vs.无TP53突变,HR=0.7,95%CI 0.29-1.64)。
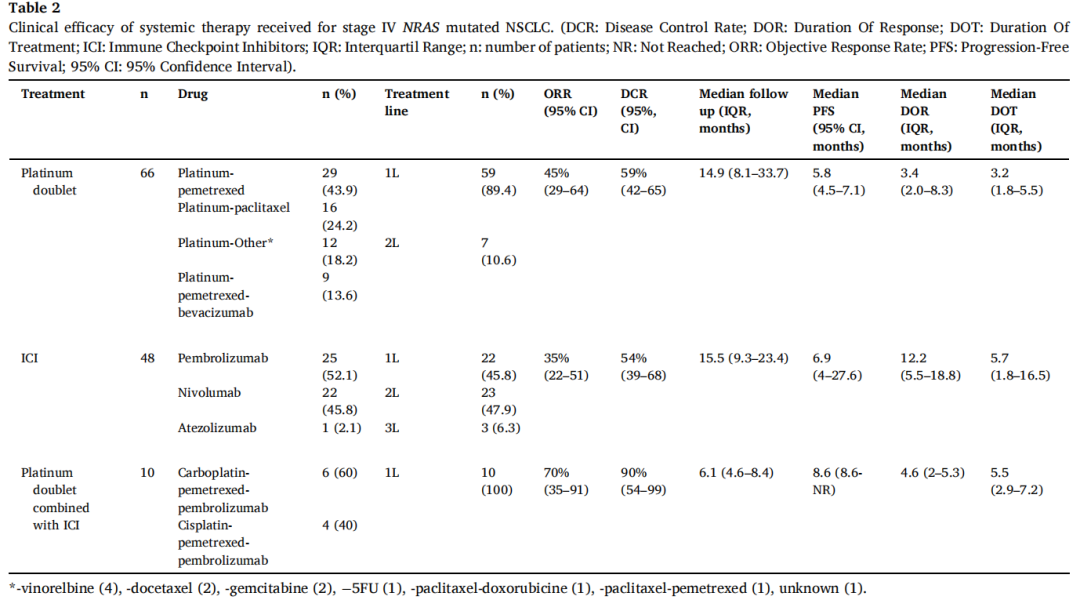
表2
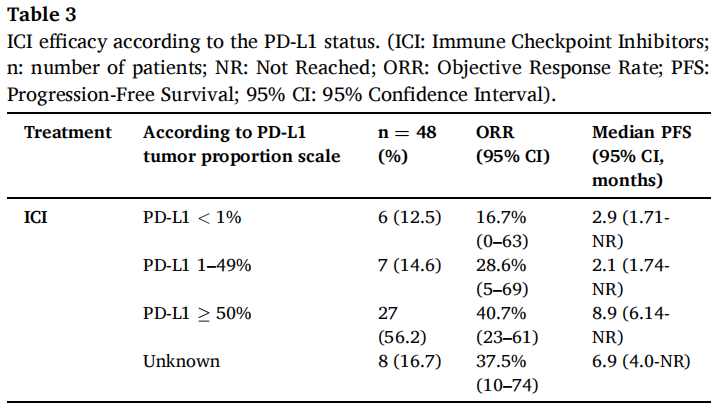
表3
接受靶向治疗的EGFR或ALK共变异的NRAS突变患者:
在5例携带EGFR突变或ALK重排的NRAS突变患者中,2例接受了基于基因检测结果的靶向治疗。这2例患者中的1例为从未吸烟的女性,患转移性肺腺癌,携带EML4-ALK重排和NRAS Q61R突变。阿来替尼治疗进展时再次活检的分子分析未检测到任何NRAS突变,而是显示了与EML4- ALK重排相关的MET扩增(FISH:MET/CEP7=5.34)。随后开始克唑替尼进行后续治疗,患者达到部分缓解,并且在2.6个月后仍在继续使用。第二例接受靶向治疗的患者是一名非吸烟女性,转移性肺腺癌,EGFR L858R突变。一线吉非替尼治疗进展后,检出EGFR T790M突变,接受二线奥希替尼治疗6.4个月。在奥希替尼治疗进展后获得的肿瘤样本中,研究者发现了与EGFR L858R突变相关的NRAS Q61K突变,而EGFR T790M突变不再检测到。
讨 论
本研究显示,NRAS突变NSCLC患者具有共同的临床、病理和分子特征,包括高频的吸烟史、肺腺癌和密码子61突变率。研究者还报道了与NRAS突变相关的致癌基因组共变异的存在。此外,研究者还描述了铂类为基础的化疗、免疫治疗以及免疫联合化疗在转移性NRAS突变NSCLC患者中的疗效。最后,研究者在1例接受奥希替尼治疗后进展的EGFR突变NSCLC患者中检测到NRAS第61号密码子突变,提示这一分子变异可能是第三代EGFR TKI获得性耐药的机制。
在本研究中,NRAS突变NSCLC患者多为男性,并且目前或既往吸烟。诊断时的中位年龄为62岁,最常见的组织学类型为腺癌。这些特征与Ohashi 等人在NRAS突变NSCLC系列研究中发现的相似。在KRAS突变的NSCLC患者中也观察到类似的情况,这些患者诊断时的中位年龄为60-70岁,与高吸烟率和高肺腺癌发生率相关。值得注意的是,在一篇文献中描述的7例HRAS突变NSCLC患者中,中位年龄为61岁,均为当前吸烟者或既往吸烟者,最常见的组织学类型为腺癌。这表明携带RAS GTPase编码基因突变的NSCLC具有共同的临床病理特征。
迄今为止,NRAS突变NSCLC中PD-L1表达水平仅在7例患者中有描述,其中只有1例患者的PD-L1表达水平≥50%。在本研究中,在通过IHC可评估PD-L1表达情况的133例患者中,42.9%的PD-L1表达水平≥50%。相比之下,在现实生活的研究中,在未经选择的NSCLC中,PD-L1表达水平≥50%的患者占比22%~36%,在KRAS突变的NSCLC中为33%~45%。一些研究也描述了NSCLC中PD-L1高表达和KRAS突变之间的显著关联。NRAS突变NSCLC中PD-L1表达水平≥50%的比例似乎与KRAS突变NSCLC中观察到的比例接近,这提示NRAS突变与PD-L1高水平表达之间可能存在关联。然而,本研究没有包括无NRAS突变的对照组,因此研究者无法具体回答这个问题。
本研究中,大多数NRAS突变发生在密码子61,最常见的是Q61L、Q61R和Q61K。密码子12和密码子13突变分别仅占16.5%和4.9%。Ohashi等报道了NRAS突变NSCLC的类似分子谱,其中80%的突变发生在密码子61内。此外,在密码子61突变中,最常见的也是Q61L/R/K突变。在黑色素瘤、甲状腺癌和其他一些实体瘤中,NRAS密码子61突变也占大多数。这与KRAS突变的分子特征相反,在肺癌和其他一些实体瘤中,KRAS突变主要发生在第12号密码子。黑素瘤的临床前数据表明,这些差异可能与NRAS第12号密码子突变的致癌性低于NRAS第61号密码子突变和KRAS第12号密码子突变相关。
在本研究中,大约67%的患者至少有一个与NRAS突变相关的基因组共变异。这些共变异可在肿瘤抑制基因、MAPK通路蛋白编码基因、PI3K通路蛋白编码基因或酪氨酸激酶受体编码基因中发现。在NRAS突变NSCLC系列中,Ohashi等人也描述了1例携带KRAS G12A共突变的患者和另1例MET扩增共变异的患者。在KRAS突变的NSCLC中,最常报道的共变异是TP53、SKT11和KEAP1突变。这些共变异可能对KRAS突变NSCLC的生物学特性及患者的预后产生影响。KRAS/TP53共突变的NSCLC具有炎症标志物和免疫检查点效应分子的增加,并且可以从ICI治疗中获得重要的临床获益。转移性KRAS突变的NSCLC在STK11或KEAP1/ NFE2L2共突变的情况下,总生存率显著降低。在本研究中,KEAP1和NFE2L2基因没有被NGS panels覆盖,而TP53和STK11仅部分被覆盖。因此,这些共变异的确切发生率及其对全身性治疗效果的影响仍然难以估计。研究者需要进一步使用统一的NGS panel系统地覆盖STK11、 KEAP1、NFE2L2和TP53,以评估这些共变异的确切频率及其对NRAS突变NSCLC预后的影响。
在本研究中,1例EGFR突变NSCLC患者在奥希替尼治疗进展时发生了NRAS Q61K突变。多项研究表明,在EGFR突变的细胞模型中,NRAS突变如Q61K可诱导对第1代和第3代EGFR TKIs耐药。然而,据研究者所知,到目前为止,还没有文献报道过NRAS第61号密码子突变在EGFR突变NSCLC患者EGFR TKI治疗进展中的作用。值得注意的是,NRAS突变也被描述为KRAS G12C NSCLC对sotorasib或adagasib耐药的常见机制。虽然临床前数据表明,通过MEK抑制剂抑制MAPK通路可以克服由NRAS突变介导的耐药,但目前临床上还没有经过验证的策略来管理这种类型的耐药机制。NRAS突变对靶向治疗耐药的影响也可能因靶向治疗的类型或肿瘤的基因背景而异。因此,本研究中的另一例患者在阿来替尼治疗开始前有ALK重排和NRAS突变共变异,并且在阿来替尼进展的活检中仅检测到MET扩增,这提示初始NRAS突变不是ALK TKI耐药的原因。
目前尚无NRAS基因突变的转移性NSCLC患者接受全身治疗的预后和疗效数据。转移性NRAS突变NSCLC患者的中位OS为15.3个月。这一结果接近于KRAS突变转移性NSCLC患者13个月的中位OS。在本队列中,铂类化疗、单独免疫治疗和免疫治疗联合化疗的肿瘤缓解率和中位PFS分别为45%和5.8个月,35%和6.9个月,70%和8.6个月。与评估非鳞状NSCLC单独免疫治疗或联合化疗的3期试验的历史数据相比,这些结果并不表明NRAS突变对全身性治疗的疗效有任何负面影响。然而,将真实世界数据与3期试验进行比较仍然困难,研究者需要在无NRAS突变的对照组中开展更大规模研究,以正确评估NRAS突变对以铂类为基础的化疗以及联合或不联合化疗的免疫治疗疗效的影响。
目前,针对RAS蛋白的一些新的治疗方法正在开发中。然而,迄今为止,还没有试验专门评估这些策略在NRAS突变NSCLC中的应用。在不可切除的NRAS突变黑色素瘤中,随机多中心III期试验NEMO报告,与接受化疗的患者相比,接受MEK抑制剂binimetinib治疗的患者中位PFS有小幅但显著的增加(2.8个月vs 1.5个月(p<0.001))。临床前数据也显示MEK抑制剂在NRAS突变的NSCLC的几个细胞模型中有效。这就提出了评估MEK抑制剂在常规治疗失败后的晚期NRAS突变NSCLC治疗中的作用的问题。在选择患者时,未来评估这一策略的研究可能必须考虑NRAS突变与其他致癌基因共变异的可能关联。
本研究有主要与回顾性设计相关的几个局限性。用于分子分析的患者随访和NGS检测结果尚未统一,并且依赖于各研究中心的当地实践。此外,研究者未能集中进行肿瘤缓解情况评估和分子学分析。最后,由于缺乏NRAS非突变对照组,限制了对NRAS突变对患者预后影响的评估。然而,这是迄今为止报道的关于NRAS突变NSCLC的最大系列研究。
NRAS突变的NSCLC患者多为男性、目前或既往吸烟、肺腺癌,中位年龄为62岁。NRAS突变主要位于第61号密码子,可能与致癌基因或抑癌基因共突变。本研究发现NRAS Q61K突变是1例EGFR突变NSCLC患者对奥希替尼耐药的潜在机制。最后,尽管在免疫治疗联合化疗的患者中观察到有前景的结果,但仍需要进一步研究来评估NRAS突变对抗肿瘤全身治疗疗效的影响。
参考文献:
Dehem, Agathe et al. “Characterization of 164 patients with NRAS mutated non-small cell lung cancer (NSCLC).” Lung cancer (Amsterdam, Netherlands), vol. 186 107393. 9 Oct. 2023, doi:10.1016/j.lungcan.2023.107393

本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言














学习新知识
50
#非小细胞肺癌# #NRAS突变# #全身治疗#
47