乳腺癌新辅助化疗未达pCR咋办?复检HER2,1/4的患者重获抗HER2治疗机会!
2023-12-27 苏州绘真医学 苏州绘真医学 发表于上海
本研究结果表明,很多患者在NAC后可能经历HER2分类变化,支持NAC后残留肿瘤重新检测HER2状态。
如今,了解乳腺癌(BC)新辅助化疗(NAC)后HER2表达状态的变化变得更加重要,因为可能让更多患者获得针对HER2-low BC的有效治疗药物。分析了192例患者匹配的NAC前后BC样本。根据当前的ASCO/CAP威廉亚洲博彩公司 ,重新评估HER2免疫组化(IHC)。肿瘤分类为HER2-0(IHC0+)、HER2-low(IHC1+或IHC2+/ISH-)和HER2阳性(IHC3+或IHC2+/ISH+)。55例(28.6%)患者达到病理完全缓解(pCR)。HER2-low BC在基线肿瘤中占 75/192(39.1%),在残留肿瘤中占 48/133(36.1%)。在非pCR队列中,53例(39.9%)患者NAC后HER2分类发生变化,最常见的是从HER2-low变为HER2-0(20.3%,n = 27)。在非pCR队列中,25.6%(11/43)的基线HER2-0患者在NAC后转为HER2-low,发生这一改变的激素受体(HR)阳性肿瘤(9/23,39.1%)的比例显著高于HR阴性肿瘤(10%,2/20)。探索性分析显示,有或无HER2状态改变的非pCR患者的无病生存期和总生存期不存在显著差异。本研究结果表明,很多患者在NAC后可能经历HER2分类变化,支持NAC后残留肿瘤重新检测HER2状态。重新检测HER2状态对于评估NAC后HER2-low状态可能尤为重要,能够更好地评估哪些患者更有可能从针对HER2-low BC的治疗药物中获益。
研究背景
在乳腺癌中,人表皮生长因子受体 2(HER2)是可操作且高度敏感的治疗靶点,对 HER2 靶向治疗具有重要的预测价值。在所有新诊断的原发性乳腺癌和转移性/复发性乳腺癌中检测 HER2 状态。当免疫组化(IHC)显示HER2表达评分为3+,或IHC评分为2+ 且原位杂交(ISH)检测到基因扩增时,被归类为HER2阳性乳腺癌;当IHC评分为0或1+,或IHC评分为2+ 且基因未扩增时,被归类为HER2阴性乳腺癌。基于美国食品药品监督管理局(FDA)批准了靶向 HER2 的抗体药物偶联物(ADC)德曲妥珠单抗(T-DXd),乳腺癌治疗格局发生了变化,对乳腺癌中 HER2 阳性和阴性二元分类提出了挑战。研究显示,T-DXd在HER2-low的HER2阴性患者中具有显著的临床获益,考虑确定新的“HER2-low(HER2低表达)”类别。目前,HER2-low乳腺癌被定义为 HER2 IHC 评分为 1+,或 HER2 IHC 评分为 2+ 且 ISH 阴性表型的乳腺癌。这些HER2-low乳腺癌约占乳腺癌患者的31%-51%。
在乳腺癌中,新辅助化疗(NAC)最初于20世纪70年代后期用于炎症性或无法手术的局部晚期疾病,目的是降低患者的疾病分期,改善手术治疗选择。在过去十年中,NAC越来越多地用于具有高风险生物学特征的早期乳腺癌。NAC在乳腺癌中越来越多的应用导致保乳手术率提高,评估肿瘤对标准和新型化疗方案体内反应的临床试验增加,以及对后续治疗中治疗升级和降级的指导。据报道,NAC 后乳腺癌生物标志物状态可能改变。两项meta分析显示,使用HER2阳性和阴性二元评分系统,一小部分乳腺癌患者(5.4%和8.9%)报告了NAC后HER2表达的变化。由于 HER2 阴性到 HER2 阳性的变化并不常见,HER2 表达变化对生存结局的影响相对有限,以及缺乏针对 NAC 后 HER2 表达变化的临床试验,尚不清楚 NAC 后 HER2 表达的变化是否应改变临床管理。目前,没有关于在NAC治疗后残留乳腺癌中重新检测HER2的通用威廉亚洲博彩公司 。
T-DXd在不可切除或转移性HER2-low乳腺癌中的成功导致了HER2靶向策略用于HER2-low早期乳腺癌患者的临床研究。一项针对HER2-low、激素受体(HR)阳性早期乳腺癌的II期新辅助试验(TRIO-US B-12 TALENT,NCT04553770)的初步结果显示,T-DXd联合阿那曲唑治疗的客观缓解率为63%(10例部分缓解和2例完全缓解),单独T-DXd的客观缓解率为75%(11例部分缓解和1例完全缓解)。这项试点研究表明 T-DXd 作为新辅助治疗在 HER2-low乳腺癌患者中可能有效。
HER2 生物标志物不断发展,更好地了解接受 NAC 的乳腺癌患者的 HER2 表达变化变得更加重要,可能会增加患者使用潜在有效新型治疗药物的机会,原本这些患者因原发肿瘤表型被排除在外。本研究探索了 NAC 前初始肿瘤和 NAC 后残留肿瘤的 HER2 表达状态,重点关注纳入 HER2-low类别后,NAC 治疗后 HER2 分类的变化。
研究结果
重新评估HER2 IHC后肿瘤HER2状态的重新分类
回顾了罗切斯特大学医学中心 2008 年 1 月至 2022 年 11 月期间接受 NAC 然后手术的乳腺癌患者,纳入了 192 例有初始活检和匹配的 NAC 后手术样本以及详细随访信息的患者。在192例NAC前肿瘤中,31例(16%)最初报告的和根据2018和2023 ASCO/CAP HER2检测威廉亚洲博彩公司 由两名乳腺病理专家重新评估的IHC评分发生了变化,导致20例(10.5%)重新分类,其中11例(5.7%)从HER2-low(1+)变为HER2 0(0+),9例(4.8%)从HER2 0(0+)变为HER2-low(1+)。在137 例 NAC 后有残留肿瘤的患者中,92 例有最初报告的评分。在这 92 例患者中,16 例(17.3%)最初报告和重新评估的 IHC 评分发生了变化,导致 8 例(8.6%)重新分类,其中 4 例(4.3%)从 HER2-low(1+)变为 HER2 0(0+),4 例(4.3%)从 HER2 0(0+)变为 HER2-low(1+)。
192例患者的基线临床病理特征及肿瘤对NAC的反应
表 1 列出了本研究中 192 例患者的 NAC 前基线临床病理特征。简而言之,研究人群的中位年龄为 53 岁(范围:22-92 岁),40.1%(n = 77)的患者小于 50 岁。大多数患者初始诊断时为浸润性导管癌(93.8%),核分级为2或3(94.3%),临床分期为II或III(76%)。192例患者中,110例(57.3%)ER阳性,82例(42.7%)ER阴性。所有患者均接受标准化疗,54/62 例(87.1%) HER2 阳性肿瘤患者接受了 HER2 靶向疗法(曲妥珠单抗和/或帕妥珠单抗)作为 NAC 方案的一部分。NAC治疗后切除样本的病理学检查显示,28.6%(55/192)的患者达到病理完全缓解(pCR),其中HER2-0、HER2-low和HER2阳性肿瘤分别为21.8%(12/55)、22.7%(17/75)和41.9%(26/62)(图1)。HER2阳性组的pCR率显著高于HER2-0组(p = 0.02)和HER2-low组(p =0.01)。HER2-0组和HER2-low组的pCR率无显著差异(p = 0.90)(图1)。
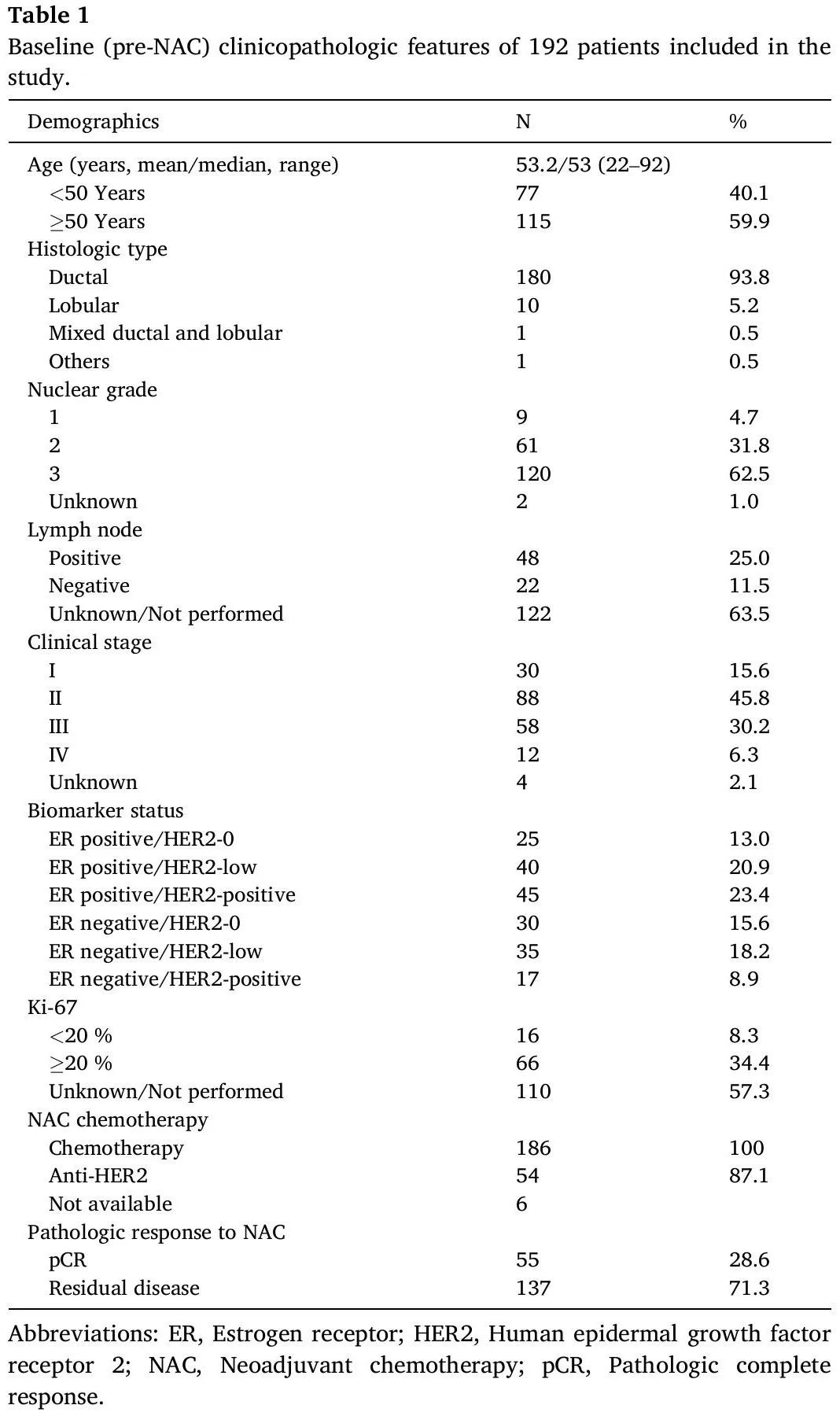
表1
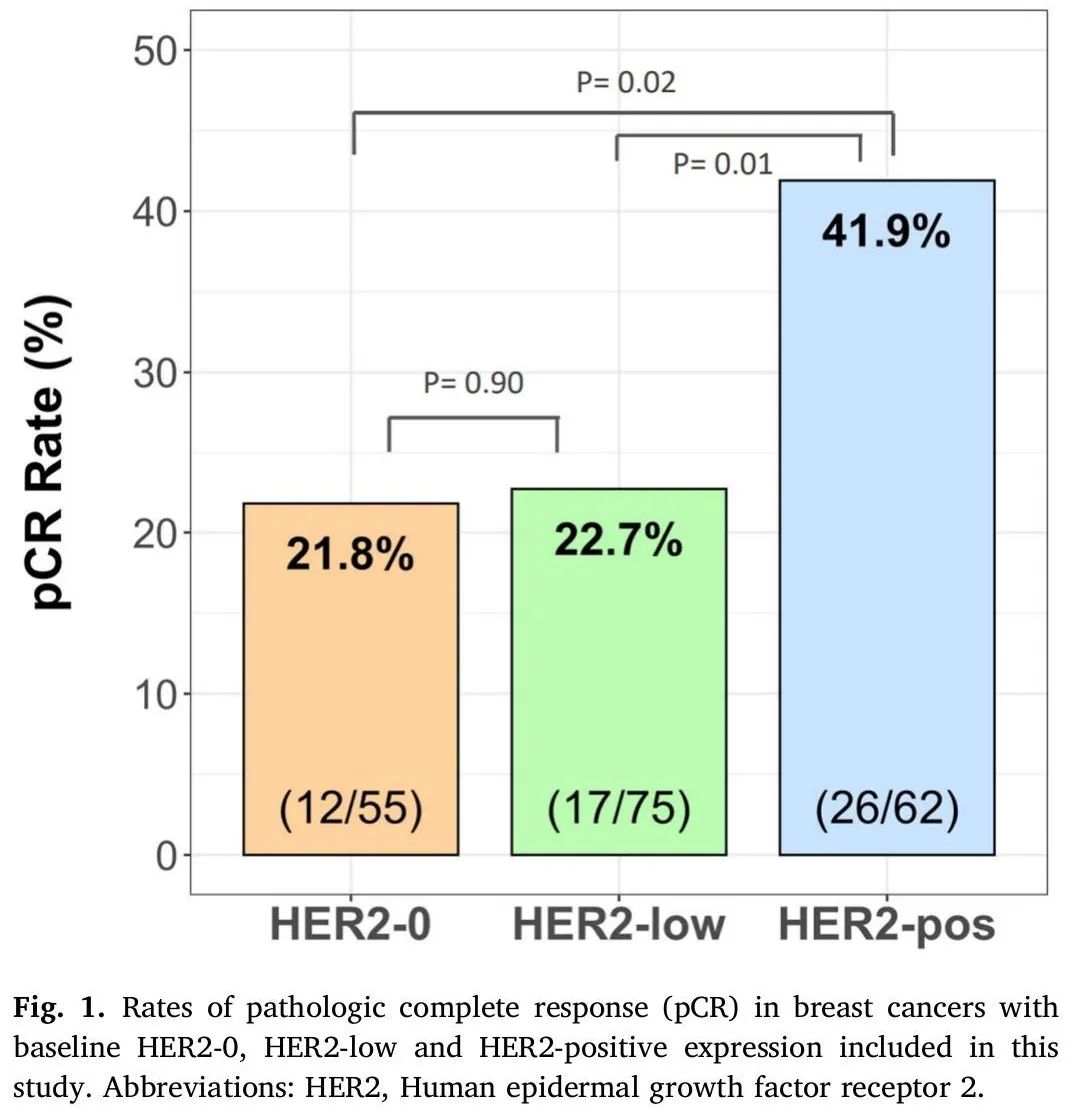
图1
192例患者NAC前后样本HER2-0、HER2-low和HER2阳性的分布
在NAC前队列(n=192)中,HER2-0、HER2-low和HER2阳性肿瘤分别占28.6%(n=55)、39.1%(n=75)和32.3%(n=62)。在NAC后队列(n = 133)中,HER2-0、HER2-low和HER2阳性肿瘤分别占49.6%(n = 66)、36.1%(n = 48)和14.3%(n = 19)(表2A)。在HR阳性肿瘤(n = 110)中,HER2-0、HER2-low和HER2阳性肿瘤在NAC前活检样本中分别占22.7%(n = 25)、36.4%(n = 40)和40.9%(n = 45),在NAC后切除样本中分别占39.1%(n = 34)、42.5%(n = 37)和18.4%(n = 16)(表2B)。在HR阴性肿瘤(n = 82)中,HER2-0、HER2-low和HER2阳性肿瘤在NAC前活检样本中分别占36.6%(n = 30)、42.7%(n = 35)和20.7%(n = 17),在NAC后切除样本中分别占69.6%(n = 32)、23.9%(n = 11)和6.5%(n = 3)(表2C)。
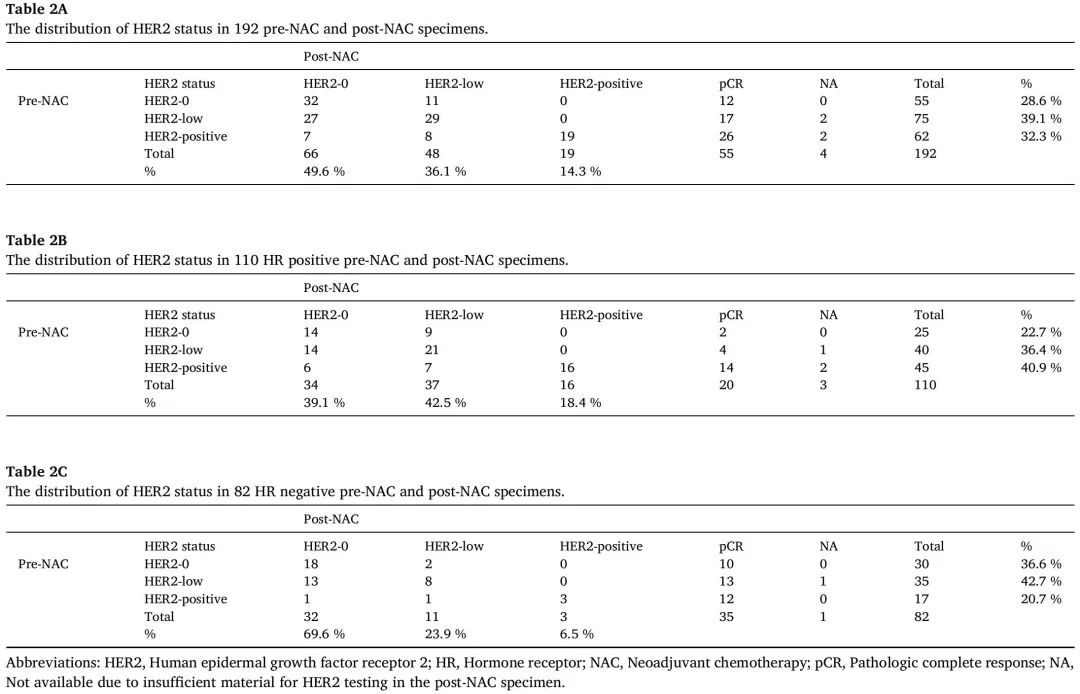
表2
非pCR队列NAC前后配对样本HER2-0、HER2-low和HER2阳性的比例
在 137 例有残留病灶的患者中,133 例 NAC 后样本有足够的肿瘤细胞用于 HER2 检测。在133例非pCR患者的NAC前样本中,HER2-0、HER2-low和HER2阳性的比例分别为32.3%(n=43)、42.1%(n=56)和25.6%(n=34)。NAC后,HER2-0、HER2-low和HER2阳性的比例分别为49.6%(n=66)、36.1%(n=48)和14.3%(n=19)。在HR阳性肿瘤中,NAC前后样本HER2-0、HER2-low和HER2阳性的比例分别从26.4%变为39.1%,从40.2%变为42.5%,从33.3%变为18.4%。在HR阴性肿瘤中,HER2-0、HER2-low和HER2阳性的比例分别从43.5%变为69.6%,从45.7%变为23.9%,从10.9%变为6.5%(图2)。
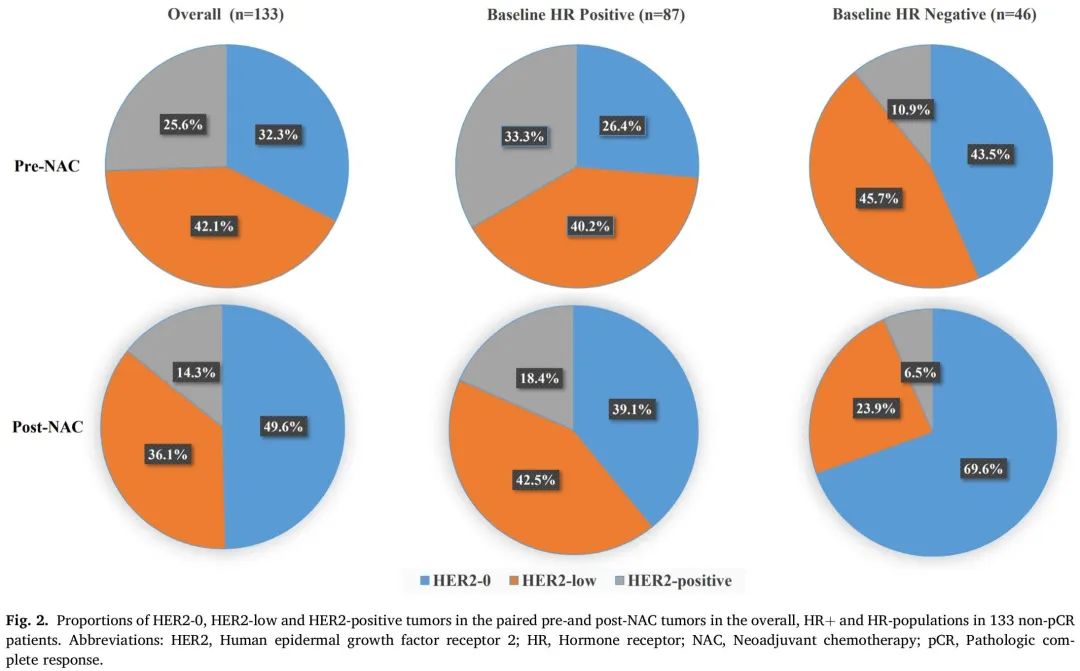
图2
非pCR队列NAC后HER2分类变化
图 3 显示了总体HR 阳性和 HR 阴性非 PCR 队列 NAC 前后配对样本的 HER2 分类变化。在133 例患者中,有 53 例(39.9%)患者 NAC 前活检样本和 NAC 后切除样本的 HER2 状态不一致,其中 8.3%(n = 11)从 HER2-0 变为 HER2-low,20.3%(n = 27)从 HER2-low 变为 HER2-0,11.3%(n = 15)从 HER2 阳性变为 HER2-low(n = 8)或 HER2-0(n = 7)。在非 PCR 队列中,25.6%(11/43)的 NAC 前活检样本 HER2-0 患者手术切除样本变为 HER2-low,而 48.2%(27/56)的 NAC 前活检样本 HER2-low患者手术切除样本变为 HER2-0。在基线 HER2 阳性组中,44.1%(15/34)的患者手术切除样本变为 HER2-low(23.5 %,8/34)或 HER2-0(20.6 %,7/34)。在 HR 阳性队列中,41.3%(36/87)的患者 NAC 前活检样本和 NAC 后切除样本的 HER2 状态不一致,其中 10.3%(n = 9)从 HER2-0 变为 HER2-low,16.1%(n = 14)从 HER2-low 变为 HER2-0,14.9%(n =13)从 HER2 阳性变为 HER2-low或 HER2-0。在 HR 阴性队列中,37.0%(17/46)的患者 NAC 前活检样本和 NAC 后切除样本的 HER2 状态不一致,其中 4.3%(n = 2)从 HER2-0 变为 HER2-low,28.3%(n = 13)从 HER2-low 变为 HER2-0,4.4%(n = 2)从 HER2 阳性变为 HER2-low或 HER2-0。HR 阳性乳腺癌(39.1%,9/23)HER2 状态从 HER2-0 变为 HER2-low 的发生率似乎高于 HR 阴性乳腺癌(10%,2/20),并且差异具有统计学意义(p = 0.029)。
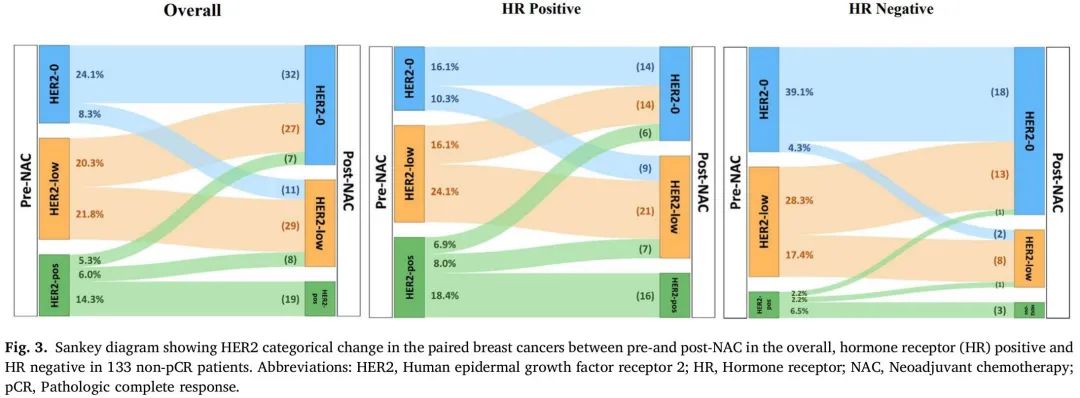
图3
NAC前后匹配样本HER2状态不一致患者的形态学评估
53 例 NAC 前后匹配样本 HER2 状态不一致的患者基于形态学的评估(表3)显示,16 例具有临界 HER2 IHC 染色细胞(接近10%阈值),6 例具有明显的样本问题,NAC 前活检样本存在少量肿瘤细胞,4 例具有形态学异质性,组织学类型或组织学分级发生变化(3 级到 1 级),6例具有明显的HER2 IHC染色异质性,2例具有明显的分析前和分析因素(挤压伪影)。大多数患者(n = 30)关于 HER2 不一致没有显著的形态学/基于 IHC 的解释。图 4 显示了一例患者具有明显的形态学异质性,导致 NAC 前和 NAC 后残留肿瘤的 HER2 IHC 染色异质性。

表3
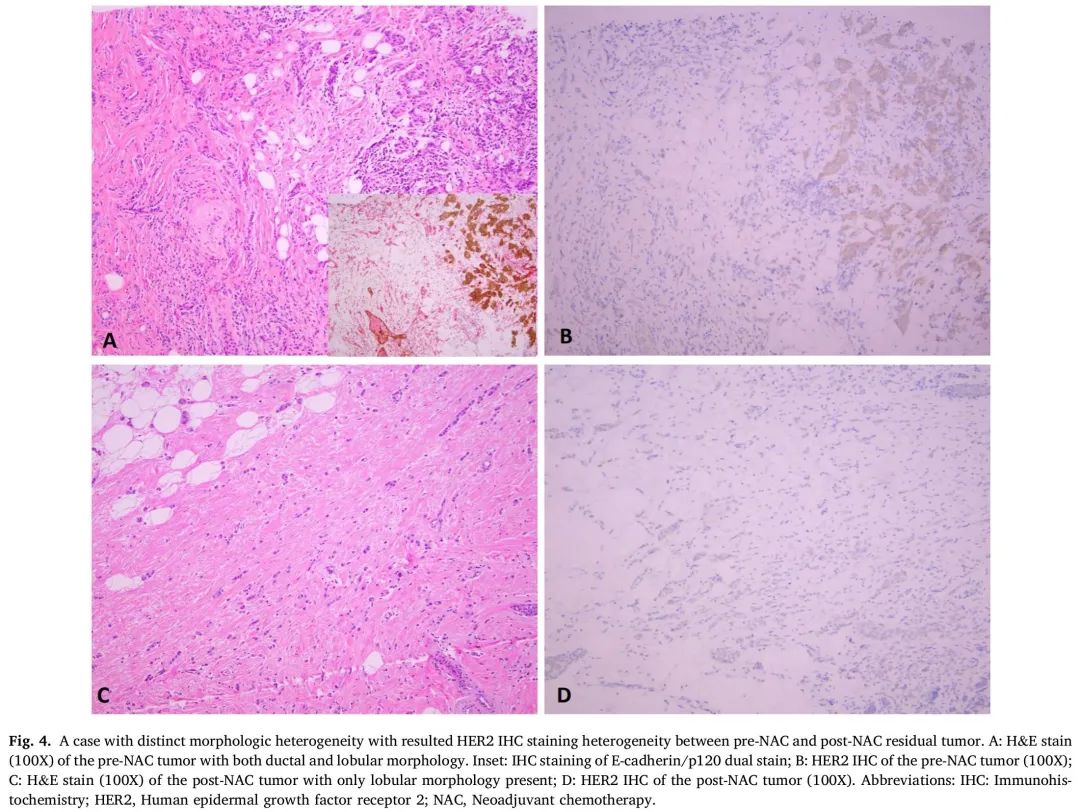
图4
临床随访
中位随访 49.2 个月时,在 NAC 前 HER2-0 患者中,16 例出现复发/远处转移,15 例死亡。在NAC前 HER2-low患者中,14例出现复发/远处转移,8例死亡。在NAC前HER2阳性患者中,9例出现复发/远处转移,3例死亡。对非pCR患者的探索性无病生存期(DFS)和总生存期(OS)分析显示,有(n = 11)和无(n = 32)HER2状态变化的HER2-0肿瘤没有显著差异(DFS p = 0.17;OS p = 0.74),有(n = 27)和无(n = 29)HER2状态变化的HER2-low肿瘤没有显著差异(DFS p = 0.23;OS p = 0.25),有(n = 15)和无(n = 19)HER2状态变化的HER2阳性肿瘤没有显著差异(DFS p = 0.25;OS p = 0.33)。图 5 展示了基线 HER2-0/low/阳性非pCR患者的 DFS 和 OS Kaplan-Meier 曲线,根据NAC后有或无 HER2- 状态变化分类。
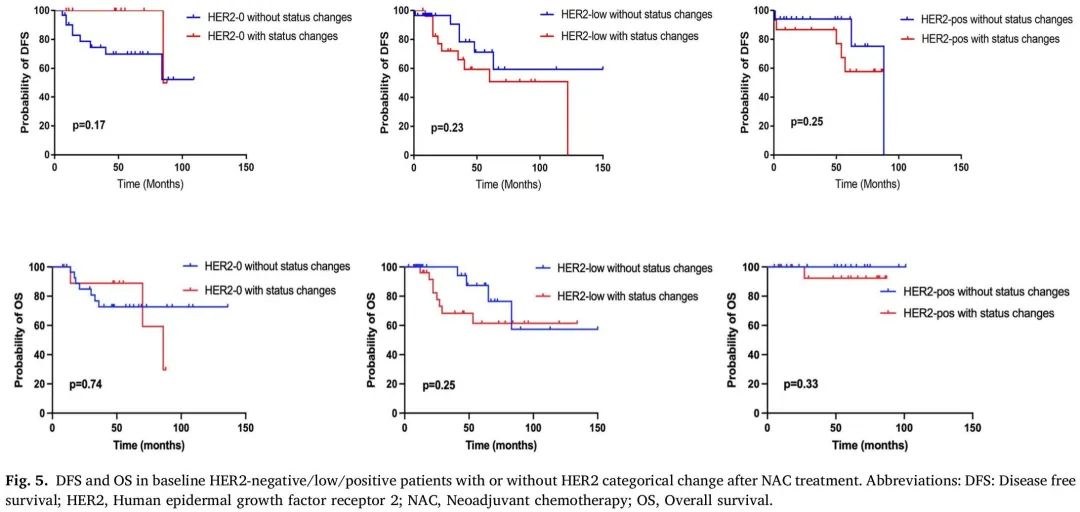
图5
讨 论
靶向HER2的ADC用于HER2-low乳腺癌重塑了晚期乳腺癌的治疗范式,HER2-low作为早期高危乳腺癌治疗靶点的临床意义正在探索中。在本研究中,williamhill asia 纳入了 HER2-low类别,重新评估了 192 例患者 NAC 前后配对样本的HER2 IHC,并分析了 NAC 后 HER2 状态的变化。本研究结果表明,相当多的非pCR乳腺癌患者(39.9%,53/133)NAC前后肿瘤的HER2表达状态不一致。其中,25.6%(11/43)的HER2-0肿瘤在NAC后变为HER2-low,可能获益于靶向HER2-low乳腺癌的新治疗药物。
几项研究探索了新辅助治疗下HER2-low的动态变化,但这些研究均未对所有患者中进行彻底的HER2集中审查。随着乳腺癌HER2-low类别的引入,几项研究强调了HER2评分的观察者间重现性差,特别是在低范围(0 vs 1+)患者中。williamhill asia 机构最近的一项研究表明,关于 6 名乳腺病理学家 100% 的观察者间一致率,在 IHC 3+ 类别中,HercepTest 为 85%,4B5 为 91.6%;而在HER2-0和HER2-low患者中,HercepTest(33.5%–41%)和4B5(26.4%–43.2%)抗体的观察者间一致性率均显著较低。在这项研究中,williamhill asia 根据 2018 和 2023 ASCO/CAP 威廉亚洲博彩公司 ,对所有 HER2 IHC 切片进行了重新评估,以减少分析后评分差异。williamhill asia 的结果显示,总体而言,大约 10% 的患者在 HER2 IHC 重新评估后被重新分类,均在 HER2 0 和 HER2-low患者之间。
在乳腺癌中引入“HER2-low”概念后,研究显示,总体NAC前后HER2不一致率在19.5%-36.5%之间,主要由从HER2-low到HER2-0或从HER2-0到HER2-low的分类变化驱动。williamhill asia 对 HER2 IHC 进行集中审查的研究结果显示,133 例非 pCR 患者中,总体发生 HER2 状态变化的患者比例略高(39.9%),趋势相似:20.3% 的患者经历了从 HER2-low 到 HER2-0 的分类变化,8.3% 的患者经历了从 HER2-0 到 HER2-low 的分类变化。在 NAC 前 HER2-low 的非 pCR 患者中,发生分类变化的比例为 48.2%(27/56),均变为 HER2-0,HR 阳性肿瘤为 40%(14/35),HR 阴性肿瘤为 61.9%(13/21)(图 3)。此外,最近的研究还表明,当纳入HER2-low类别时,原发性乳腺肿瘤与复发/转移性疾病之间存在显著差异。早期研究结果以及本研究结果进一步证实HER2-low乳腺癌的高度不稳定性。
为了更好地了解纳入HER2-low类别时哪些因素可能导致HER2状态变化,williamhill asia 评估了所有NAC前基线肿瘤和NAC后残留肿瘤HER2表达谱不一致患者(n = 53)的代表性切片的肿瘤形态和HER2 IHC染色模式(表3)。HER2状态变化最常见于NAC前或NAC后样本HER2染色较弱且不完全,接近10%阈值的患者(n = 16)。由于区分HER2 IHC 0和HER2 IHC1+(HER2-low)的临床重要性日益凸显,根据2023年更新的ASCO/CAP威廉亚洲博彩公司 的建议,可能有必要达成共同的第二意见,特别是对于接近10%阈值的患者。其他可能的原因包括分析前和分析因素,以及形态学和HER2 IHC染色异质性。值得注意的是,在本研究中williamhill asia 仅对一个切片进行了 HER2 IHC,这是当前真实世界病理学实践,这种做法可能低估了 HER2 IHC 异质性对 HER2 状态变化的促成作用。williamhill asia 基于形态学的评估未能识别大多数患者 HER2 表达不一致的原因(n = 30),提示在某些患者中,NAC 前基线肿瘤和 NAC 后残留肿 HER2 表达谱不一致可能是由于治疗药物导致的生物学影响。Bo等人分析了临床病理因素与NAC前后样本HER2变化的相关性,发现HER2转化与HER2靶向治疗呈正相关(r=0.18,p=0.00),HER2靶向治疗使用增加了NAC前后HER2转变率。
由于NAC前基线肿瘤和NAC后残留肿瘤之间从HER2阴性到HER2阳性的分类变化并不常见(在本研究中,n = 0),且对NAC后HER2状态变化的临床意义知之甚少,目前的治疗标准是根据患者基线肿瘤生物标志物状态进行治疗。HER2生物标志物正在不断发展,T-DXd已被证明对HER2-low转移性乳腺癌具有活性,并且可能对HER2超低表达肿瘤具有活性。本研究中,在标准新辅助化疗后,25.6%(11/43)的 HER2-0 肿瘤在 NAC 后转化为 HER2-low,并且 HR 阳性肿瘤的转化率显著高于 HR 阴性肿瘤(39.1 % vs 10.0 %,p = 0.029)。这一结果进一步表明,很多乳腺癌患者可能获益于针对HER2-low乳腺癌的新治疗方案,包括pCR率较低的HR阳性乳腺癌人群和治疗选择有限的HR阴性乳腺癌人群。基于据现有文献,以及本研究结果的支持,重新检测NAC后样本HER2状态是合理的,以便更好地评估哪些患者可能出现从HER2-0到HER2-low的HER2分类变化,可能获益于针对HER2-low BC的治疗药物。此外,重新检测NAC后样本HER2状态可以为针对满足HER2-low乳腺癌标准的患者的临床试验提供基线信息,使这些患者能够获得潜在有效的新型治疗药物,这些患者根据原发肿瘤表型会被排除在外。
与Miglietta等人的研究结果类似,williamhill asia 对非pCR队列的探索性 DFS和OS生存分析发现,有或无HER2表达变化的HER2阴性肿瘤没有显著差异。这些探索性发现可能提示,在纳入 HER2-low类别的情况下,重新检测 NAC 后残留病灶 HER2 表达的最相关意义是增加复发高风险患者获得潜在有效药物的机会,而不是预测疾病预后。由于样本量小,williamhill asia 的探索性生存分析可能不足以发现亚组差异。需要更大样本量的研究来揭示 NAC 后 HER2 分类变化的预后价值。
本研究有几个局限性。这是一项样本量相对较小的单机构研究,结果可能无法推广。此外,这是一项回顾性研究,治疗决策和NAC方案不是随机的。虽然大多数患者(n=152)至少随访了4年,但2022年收集的40例患者也被纳入研究,以了解纳入HER2-low类别后HER2状态的变化,这些患者随访时间短,可能影响了williamhill asia 的探索性生存分析。
总之,本研究首次对 192 例患者配对的 NAC 前后样本重新进行了HER2 IHC评估,发现纳入 HER2-low类别时,相当大比例(39.9%)的乳腺癌患者 NAC 前后配对肿瘤的 HER2 分类发生变化。25.6%(11/43)的基线 HER2-0 患者在 NAC 后变为 HER2-low,并且这种分类变化在 HR 阳性肿瘤中更为显著。本研究结果支持在NAC后有残留病灶的患者中重新检测HER2表达,这有助于识别可能获益于针对HER2-low BC的HER2药物的患者。需要进行更大队列研究,以验证本单机构经验,并进一步探索 NAC 后 HER2 分类变化的预后价值。
参考文献:
Karakas C, Tyburski H, Turner BM, Weiss A, Akkipeddi SMK, Dhakal A, Skinner K, Hicks DG, Zhang H. HER2 categorical changes after neoadjuvant chemotherapy: A study of 192 matched breast cancers with the inclusion of HER2-Low category. Hum Pathol. 2023 Dec;142:34-41. doi: 10.1016/j.humpath.2023.11.003. Epub 2023 Nov 17. PMID: 37979952.

本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













认真学习了
60
好文章,谢谢分享。
40
#乳腺癌# #HER2#
77