
研究成果概述
2024年1月16号,浙江大学何赛灵研究团队在国际分析化学老牌权威学术期刊《Analytical Chemistry》发表单分子蛋白分析最新技术研究。该工作首次报道了一种具有高通量应用潜力的单分子蛋白质分析仪。使用带有DNA标记抗体的镀金磁性纳米颗粒进行靶标识别和分离。将免疫复合物加载到离心产生的微滴中。DNA的免疫PCR扩增能够在单分子水平上对蛋白质进行定量。本研究中,实现了对神经退行性疾病的生物标志物α-突触核蛋白的超灵敏检测。本方法检测限在常规缓冲液中为∼50 aM,而在血清中为∼170 aM,具有较高的特异性,亦可用于分析翻译后修饰蛋白,如蛋白质磷酸化。这项研究将促进对单分子蛋白质检测的更广泛研究,有助于疾病诊断、生物标志物发现和药物开发。

背景介绍
复杂生物介质中超低浓度蛋白质的超灵敏检测对于医学诊断、生物标志物发现、药物开发等至关重要。例如,在神经退行性疾病中,如帕金森病(PD)和阿尔茨海默病(AD),由于血脑屏障,蛋白质生物标志物通常以极低的水平存在于外周血中。使用传统方法(如酶联免疫吸附测定 (ELISA) 或化学发光)对这些生物标志物进行定量测量可能具有挑战性。因此,目前神经退行性疾病的临床诊断严重依赖医学成像和病理分析,而不是分子分析。
最近,超灵敏免疫测定显示出快速进展,例如单分子方法和电化学发光。其中,单分子免疫分析越来越受到关注。单分子分析依赖于将靶蛋白随机分配到大量微孔或微滴中再进行定量检测分析。目前,单分子免疫测定的一个主要挑战是使用基于微芯片的平台,这可能会导致两个问题。样品分配是单分子测定的关键;已经报道了几种微液滴生成方法,例如Tjunction型微流控芯片,液滴振荡和微珠阵列。第二种是使用微流控泵,这种在临床环境中很难较难应用。
文章亮点
本文提出了一种具有大规模应用潜力的单分子蛋白质分析仪,如图所示。使用镀金的磁性纳米颗粒 (Au@MNPs) 形成三明治型免疫复合物。一抗和二抗分别用双链DNA(即linker dsDNA)和单链信号DNA标记。通过连接子dsDNA的酶促切割,免疫复合物从纳米颗粒中释放出来,通过使用传统移液器吸头离心来加载到油包水(W/O)微滴中。与之前的工作相比,改进了微流控装置的设计,采用锥形尖端,以更好地控制剪切力,这对微液滴的产生至关重要。信号DNA的扩增获得单分子水平的荧光微滴,对荧光微滴进行计数可实现α-突触核蛋白(α-Syn)的超灵敏检测,血清 α-Syn 是有患 PD 风险的个体的生物标志物。
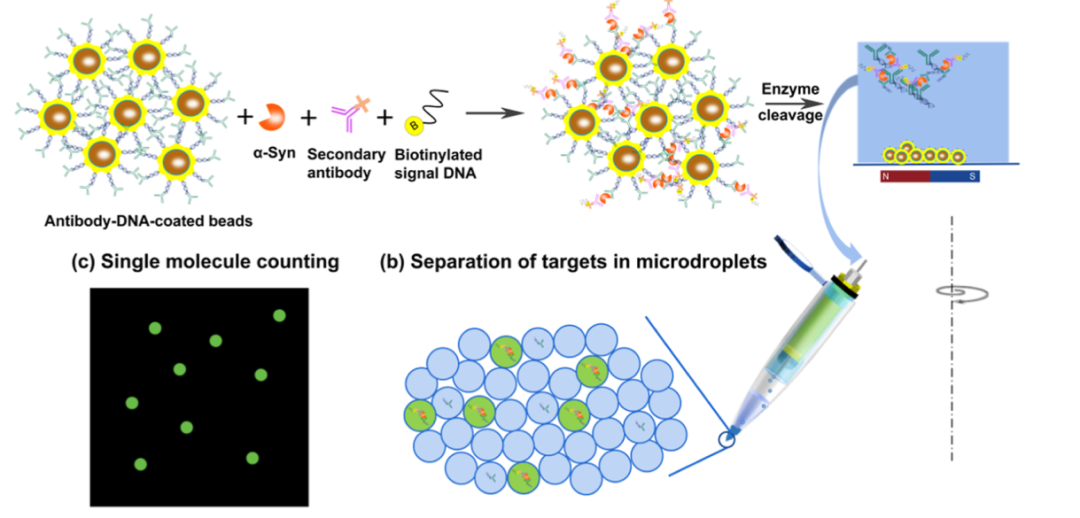
主要内容
免疫复合物的形成
通常,与Au@MNPs形成三明治型免疫复合物,这些免疫复合物被DNA标记的抗体功能化,如图(a)所示。磁芯能够从样品中分离出目标物质,并且在温和的条件下,硫代化的DNA可以很容易地修饰到金纳米颗粒上。抗α-Syn一抗通过酰胺偶联与接头dsDNA的远端偶联。二抗通过链霉亲和素-生物素相互作用与单链信号 DNA 偶联。
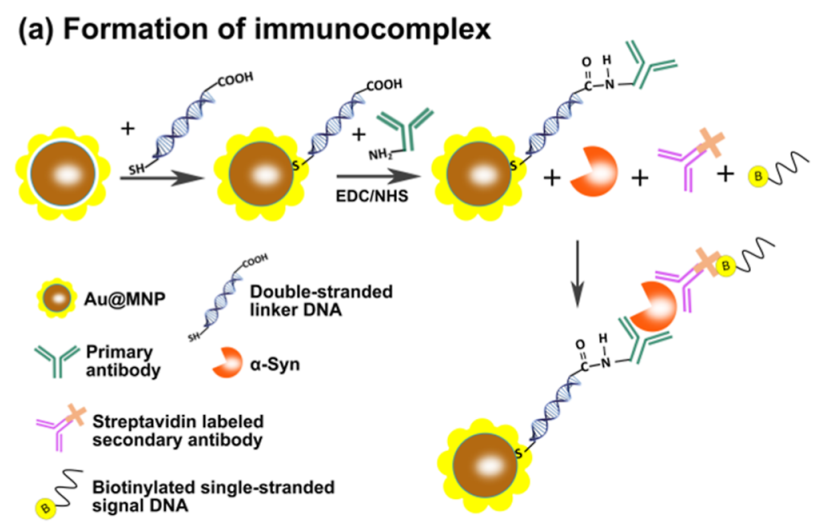
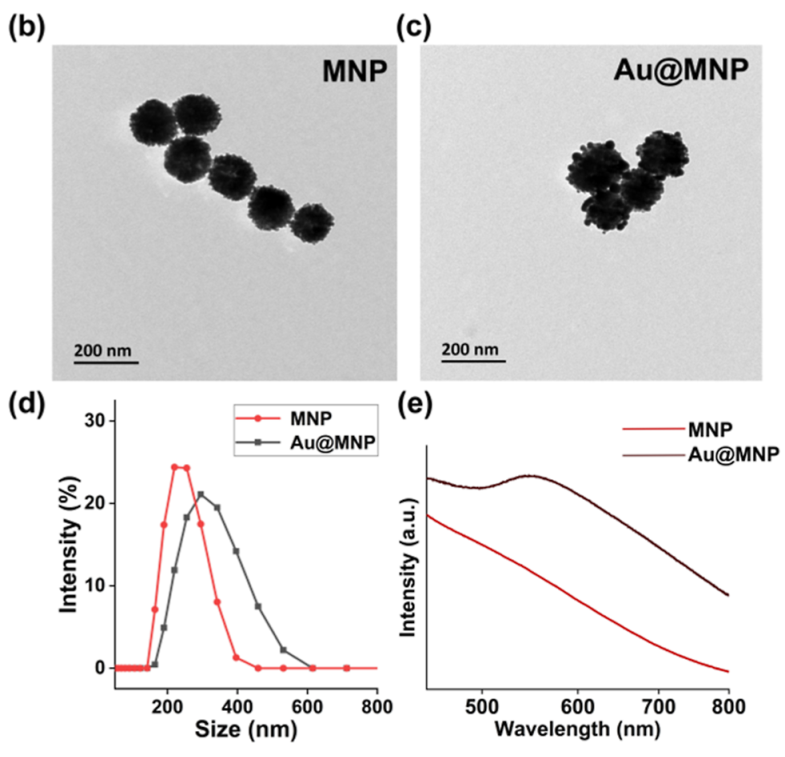
合成的Au@MNPs呈球形,在涂层前测量的直径为∼130 nm,并在金壳中增加到∼160 nm,如TEM所示(1b,c)。DLS测量表明,Au@MNPs的平均尺寸为∼320 nm(1d),这表明纳米颗粒可能聚集。重要的是,聚集不会影响免疫测定的性能,因为只有抗体-靶标复合物会被加载到微滴中,而不会加载到磁性纳米颗粒中。这项工作主要Au@MNPs用于目标分离。williamhill asia 之所以使用它们,主要是因为它们的表面化学成分可靠。例如,Au-S、酰胺和生物素-链霉亲和素键都可以很容易地正交形成。可以使用商用磁珠,例如Dynabeads,但可能需要不同的表面改性策略。纳米颗粒的紫外-可见吸收光谱如图e所示。在镀上金壳后,Au@MNPs在∼540 nm处表现出新的吸收带,这在未涂层的纳米颗粒中没有观察到。不光滑的金壳可能导致相邻的金纳米颗粒簇的偶联,从而导致吸收峰的红移。
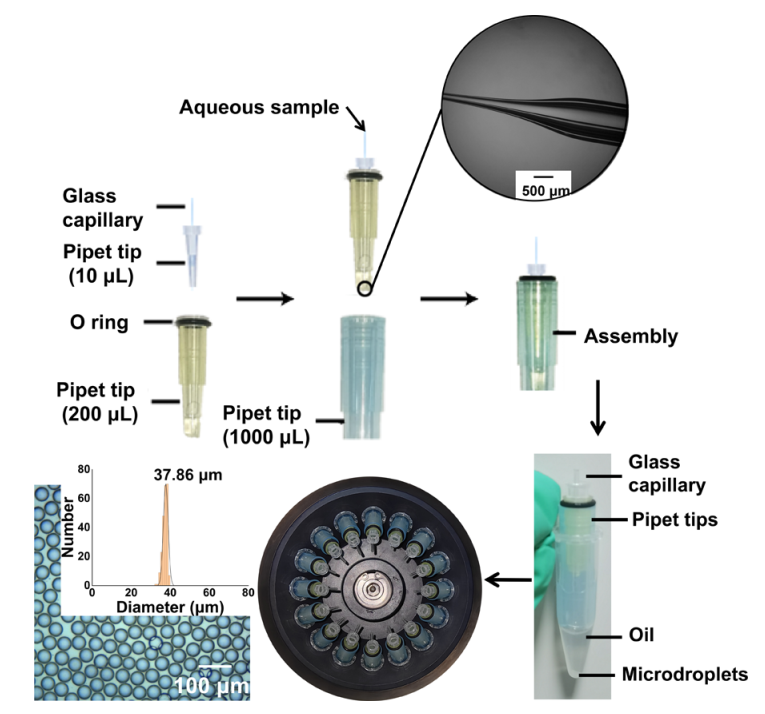
微滴的生成
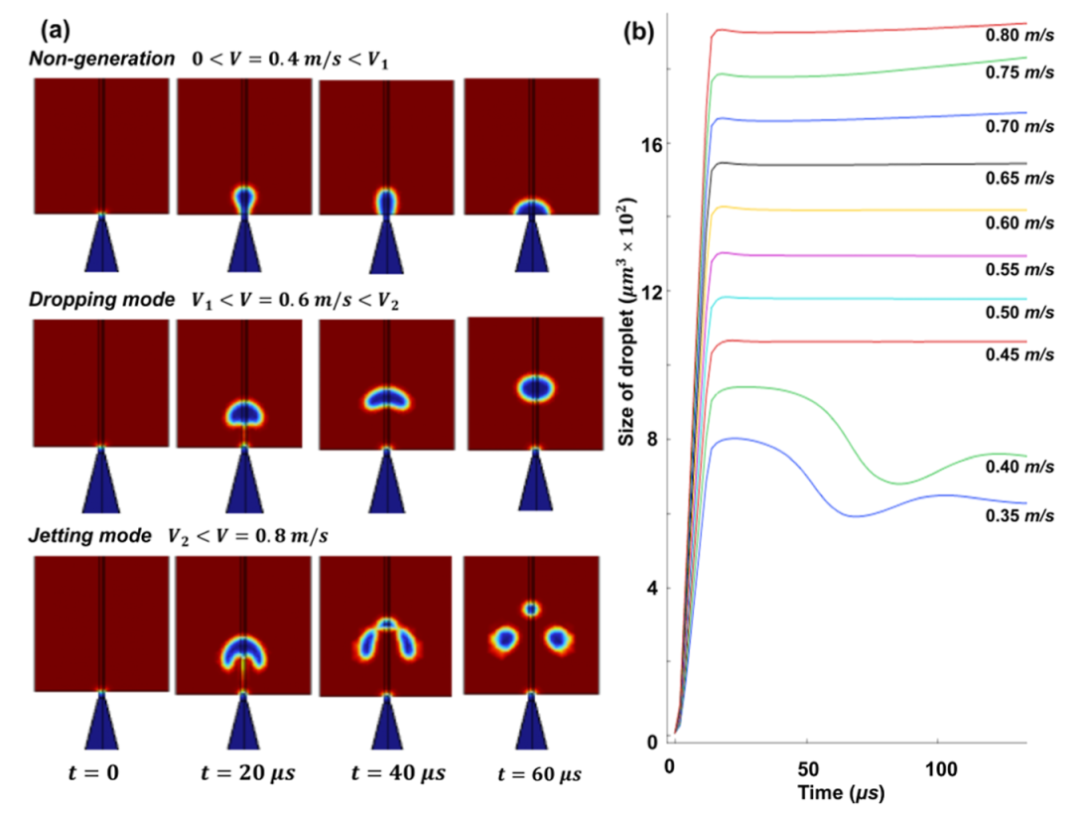
下图显示了本研究中使用的微滴发生器。原则上,该装置的工作原理是控制固定在移液器吸头组件内的玻璃毛细管中水溶液的行为。在准静态状态下,当离心力超过毛细管尖端的表面张力时,剪切力会切断流动,并在 Eppendorf 管底部形成均匀的微滴。本研究中通过采用由微电极拉拔器制成的带有锥形尖端的毛细管来改善微滴的产生。在锥形尖端设计中,水溶液往往保持准静态状态,从而在离心过程中更好地控制剪切力。在这项研究中,改进的设计使单分散微滴的生产具有近乎完美的(100%)可重复性,而平头装置的可重复性为∼20%。此外,通过改变毛细管的直径,可以在 ∼15 到 50 μm 之间实现尺寸控制。
通常,滴落和喷射是允许在毛细管尖端形成微滴的两种机制(图a)。只有在滴液状态下才能获得均匀的微滴,而喷射可以产生不同大小的微滴,并且两种机制都由流速控制。本文在 COMSOL 仿真中引入了两种流速(V1 和 V2),以 10 μm 毛细管尖端为例,表征微滴的产生,如图 3a 所示。在非生成模式(V<v1,低速)下,没有形成微滴。在液滴模式下(v1 <="" v="" v2,中速),形成均匀的微滴。在喷射模式下(v2="" v,高速),形成不同大小的微滴。根据模拟,估计v1和v2的值分别为0.45至0.70="" m="" s,如图b所示。<="" span="">
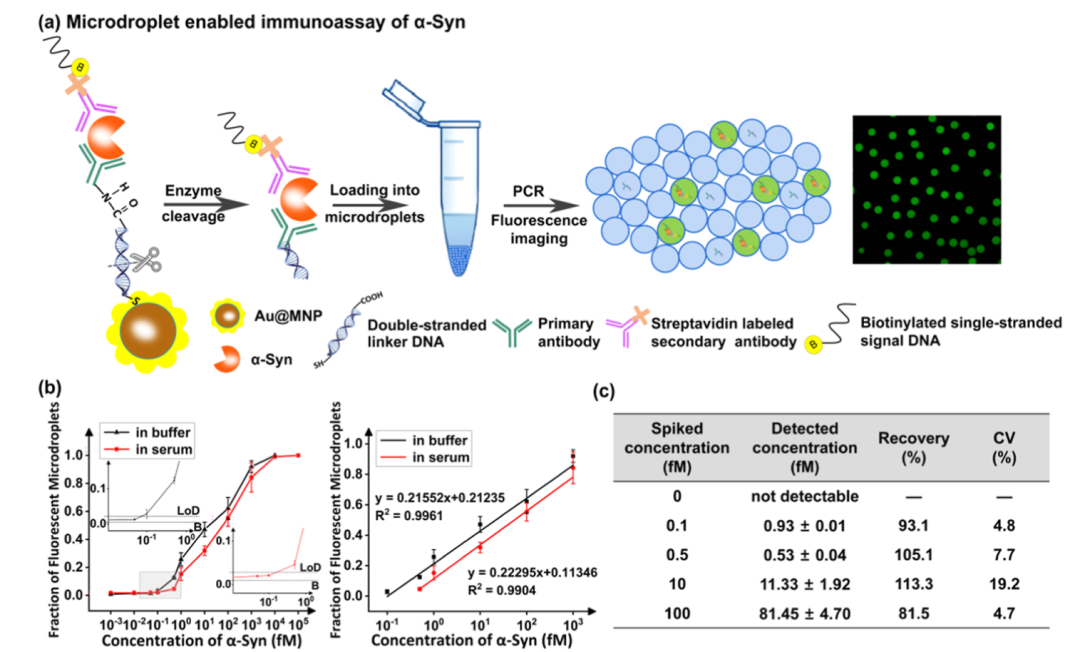
α-Syn的单分子免疫测定
通过双链DNA的酶促切割,免疫复合物从Au@MNPs表面释放出来。释放复合物将减少用单一抗体标记每个纳米颗粒的需求。将游离复合物加载到毛细管中以产生微滴,如下图a所示。产生微滴后,通过PCR扩增单链信号DNA。将样品转移进行荧光成像,并计算荧光微滴的数量和微滴的总数。在本研究中,靶向分子(例如,要测量的α-Syn)的浓度非常低,以至于在一个微滴(直径∼50μm)中具有多个分子的可能性可以忽略不计。因此,从这个意义上说,本研究实验分析可以称为“单分子蛋白质分析”。使用神经退行性疾病的生物标志物 α-Syn 评估单分子免疫测定的性能。从下图b可以看出,缓冲液和血清中的检出限(LoD)值分别为43.36 aM和173.02 aM。由于这项工作中的LoD远低于临床相关值,因此将血清稀释1000倍以计算血清加标样品的回收率。如下图c所示,回收率在81.5%至113.3%之间,这证明了该方法的稳健性。
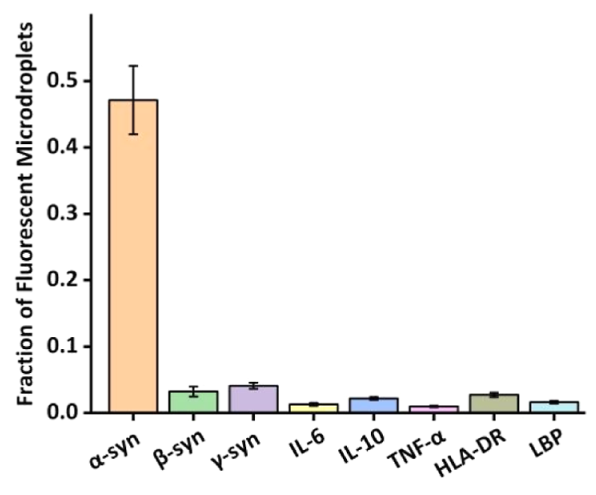
α-Syn的特异性、免疫PCR及磷酸化试验
特异性试验。研究表明,α-Syn 异构体可以作为从病理生理学到临床应用的生物标志物,并用于区分 PD.48,49 的亚型如下图所示,使用 α-Syn 和其他血清蛋白的不同异构体观察到高特异性,除靶标存在外,所有样品均呈阴性反应。这很重要,因为血清蛋白吸附引起的非特异性效应会严重影响分析反应。
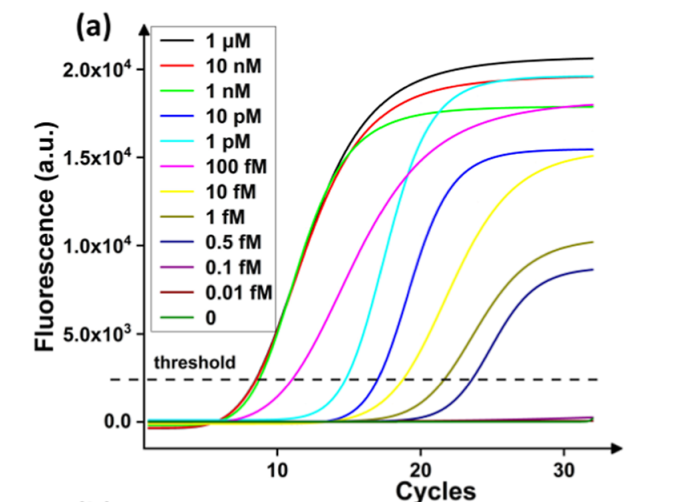
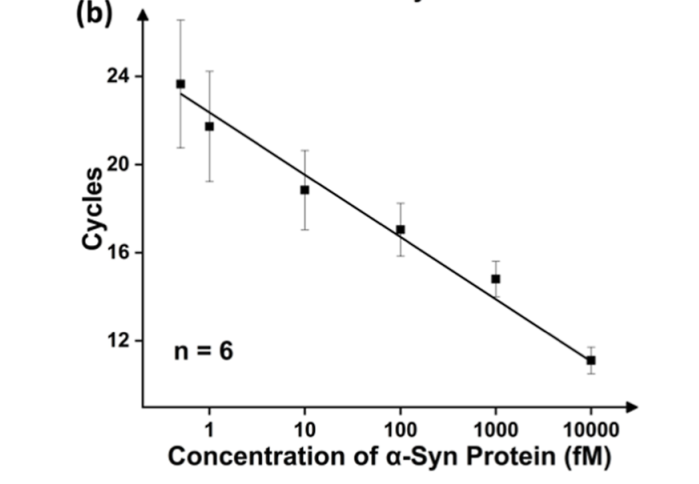
α-Syn的免疫PCR实验。为了验证测定的高灵敏度,在不使用微滴的情况下对α-Syn进行免疫PCR,但其余测定保持不变,如图6所示。结果表明,LoD估计在∼1 fM以上,比当前工作至少高出一个数量级。重要的是,免疫PCR存在重大错误,这与以前的报告一致。
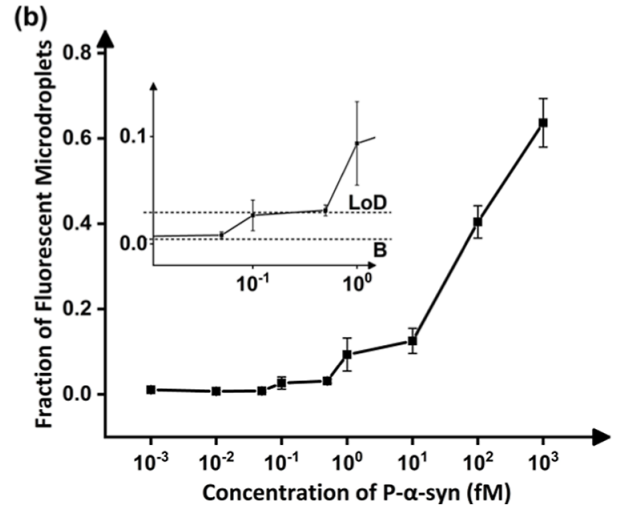
磷酸化试验。由于翻译后修饰的分析对于疾病分析很重要,因此进一步探索了单分子免疫测定在研究磷酸化方面的潜力。在这项研究中,使用单分子免疫测定法检测p-α-Syn,结果如图7所示,从中确定LoD为∼149.23 aM,远低于测量血液中磷酸化α-Syn所需的灵敏度。

文章亮点总结与讨论
本研究使用传统的移液器吸头通过离心产生均匀的W/O微液滴,锥形吸头具有近乎完美的重现性(100%),并能很好地控制微滴的大小,并得到准静态流体动力学分析的支持。使用 DNA 标记的抗体在微滴内应用免疫 PCR,可以对 α-Syn 进行单分子免疫测定,-Syn 是神经退行性疾病(如 PD 和 AD)的关键生物标志物。LoD在缓冲液中分别为∼43 aM和血清中∼173aM。线性动态范围在缓冲液中分别为 ∼0.1−1000 fM 和血清中 ∼0.5−1000 fM。免疫测定对α-Syn和其他血清蛋白的不同异构体显示出良好的特异性,可以扩展到分析翻译后修饰,如蛋白质磷酸化。
总体而言,目前的研究已经证明了一种具有 aM 灵敏度的超灵敏免疫测定法,可以在工业规模上生产并用于几乎所有研究小组。这项工作可能在免疫测定中产生广泛影响,并应用于生物标志物发现、环境监测和个性化医疗。
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















#生物标志物# #单分子蛋白#
43