J Nanobiotechnology:短细胞穿透肽缀合生物可还原聚合物增强CRISPR系统的基因编辑
2024-05-26 刘少飞 MedSci原创 发表于上海
基于CRISPR的基因疗法通过使用新型短肽结合的可生物还原聚合物TSPscp显著提高了体内外基因组编辑的效率,展示了其作为高效递送工具的潜力。
CRISPR-Cas系统在靶向编辑人类细胞方面引发了革命,开启了治疗人类疾病的新可能性。基于CRISPR的基因疗法能够精确靶向和特异性编辑疾病相关基因序列,有可能提供持久的治疗效果。值得注意的是,美国食品药品监督管理局(FDA)最近批准了首个基于CRISPR的镰状细胞病治疗,这标志着该领域的一个重要里程碑。
然而,基于CRISPR的基因疗法面临的挑战依然存在,其中一个关键障碍是如何实现对目标细胞的高效递送。尽管已经使用了病毒载体(如腺相关病毒载体)和非病毒载体(如脂质纳米颗粒和阳离子聚合物)进行CRISPR递送,但这些递送系统的有效性仍面临着预先存在的免疫风险、货物大小限制和安全性问题。
质粒DNA(pDNA)是基于CRISPR的基因疗法的理想载体,因为它具有固有的稳定性、易于大规模制备和成本效益。然而,CRISPR pDNA必须克服各种生理障碍才能发挥其功能,包括细胞进入、内涵体逃逸、核转运、转录和转录后激活,这些都需要高效的递送载体。阳离子聚合物如聚乙烯亚胺(PEI)常用于基因递送,因为它们能够屏蔽核酸货物、促进细胞摄取和帮助溶酶体逃逸。然而,高分子量PEI(例如25 kDa)虽然可以提高转染效率,但也会增加细胞毒性。因此,已经设计了低分子量PEI(例如2 kDa或800 Da)的衍生物,以平衡转染效率和细胞毒性。此外,整合细胞穿透肽提供了一种策略,通过促进大分子进入细胞来增强转染。
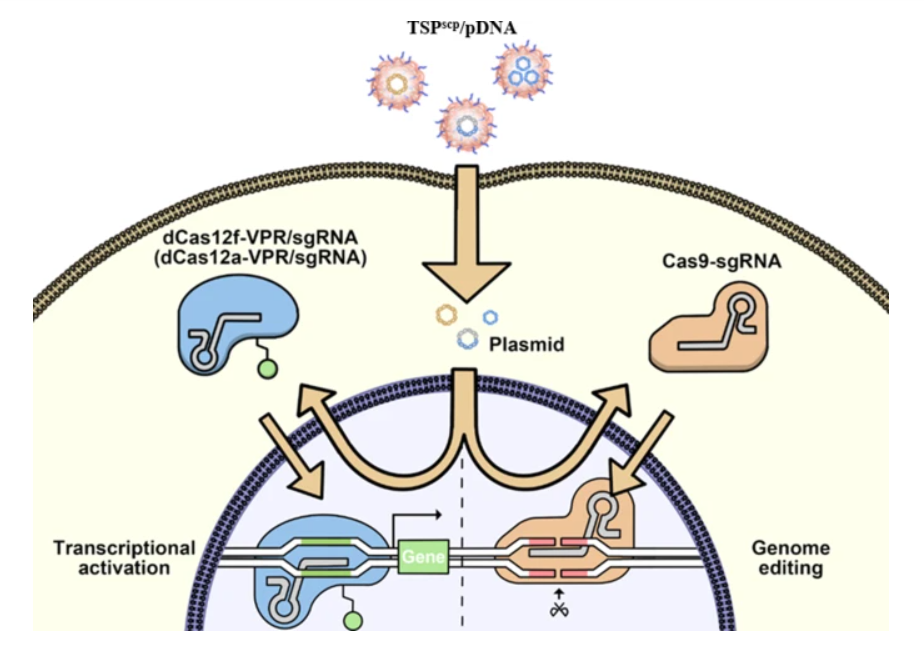
在本研究中,williamhill asia 开发了一种名为TSPscp的PEI衍生物,用于高效转染CRISPR pDNA。TSPscp是通过将吐温85与低分子量PEI 2 K通过可生物还原的二硫键连接,并整合一个短的细胞穿透肽(SCP)序列AC-TGSTQHQ-CG而创建的。SCP肽已被证明可以增强皮肤细胞中siRNA的摄取。此外,williamhill asia 之前的研究(未发表数据)表明,SCP还提高了HEK293T细胞系中质粒DNA的细胞摄取。选择PEI 2 K是因为其低细胞毒性,而使用吐温85是为了通过与低密度脂蛋白受体相互作用来增强细胞摄取和提高转染效率。TSPscp通过电子相互作用与CRISPR pDNA形成球形纳米复合物,保护DNA不被降解,增强内化,实现溶酶体逃逸,并以可生物还原响应的方式促进核转运。与商业基因转染试剂相比,该递送系统显著提高了体外的基因激活和基因组编辑效率。此外,通过去除细菌骨架,将CRISPR pDNA缩小为更小的微环DNA(MC DNA)进一步增强了基因组编辑效率。更重要的是,当TSPscp与MC DNA结合时,在小鼠皮肤局部注射后也促进了体内的基因组编辑。总的来说,williamhill asia 的研究结果突出了TSPscp作为递送CRISPR系统治疗皮肤病的有前景工具的潜力。
参考文献:
Wang X, Cai C, Lv W, Chen K, Li J, Liao K, Zhang Y, Huang H, Lin Y, Rong Z, Duan X. Short cell-penetration peptide conjugated bioreducible polymer enhances gene editing of CRISPR system. J Nanobiotechnology. 2024 May 24;22(1):284. doi: 10.1186/s12951-024-02554-w. PMID: 38790037.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言
















#基因编辑# #CRISPR系统#
29